
| A. | 该溶液的PH=4 | |
| B. | 升高温度,溶液的PH增大 | |
| C. | 稀释时溶液中所有离子的浓度都减少 | |
| D. | 此酸的电离平衡常数约为1×10-9 |
分析 室温时,0.1mol/L某一元酸HA在水中有0.01%发生电离,该溶液中c(H+)=0.1mol/L×0.01%=10-5 mol/L,
A.该溶液的pH=-lgc(H+);
B.升高温度,促进HA电离;
C.加水稀释后,溶液中c(OH-)增大;
D.此酸的电离平衡常数=$\frac{c({H}^{+})c({A}^{-})}{c(HA)}$.
解答 解:室温时,0.1mol/L某一元酸HA在水中有0.01%发生电离,该溶液中c(H+)=0.1mol/L×0.01%=10-5mol/L,
A.该溶液的pH=-lgc(H+)=-lg10-5=5,故A错误;
B.升高温度,促进HA电离,则溶液中c(H+)增大,溶液在pH减小,故B错误;
C.加水稀释后,促进HA电离,HA电离增大程度小于溶液体积增大程度,则溶液中c(H+)减小,温度不变水的离子积常数不变,则溶液中c(OH-)增大,故C错误;
D.此酸的电离平衡常数=$\frac{c({H}^{+})c({A}^{-})}{c(HA)}$=$\frac{1{0}^{-5}×1{0}^{-5}}{0.1}$=1×10-9,故D正确;
故选D.
点评 本题考查了弱电解质的电离,根据pH、电离平衡常数的计算方法即可解答,注意基础知识的掌握,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼烧某白色粉末,火焰呈黄色,证明原粉末中含有Na+,无K+ | |
| B. | 实验中要配制500mL0.2mol•L-1KCl溶液,需用托盘天平称量7.45gKCl固体 | |
| C. | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结,证明NH4Cl固体易升华 | |
| D. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加沸石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2:7或5:4 | B. | 2:1或5:4 | C. | 4:5或7:2 | D. | 2:1或7:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2H+=Ca2++CO2↑+H2O | B. | 2Fe2++Cl2=2Fe3++2Cl- | ||
| C. | HCO3-+H+=CO2↑+H2O | D. | H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物不一定都是非金属氧化物 | |
| B. | HCl、H2S、NH3都是电解质 | |
| C. | 强酸强碱都是离子化合物 | |
| D. | FeBr3、FeCl2、CuS都不能直接用化合反应制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
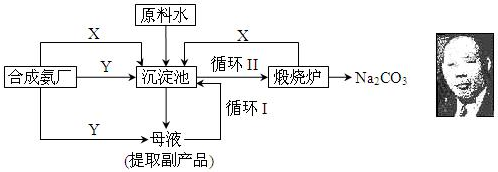
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com