
| 时间 | 0min | 2min | 4min | 6min | 8min | 10min |
| Z的浓度mol/L | 0 | 0.8 | 1.2 | 1.4 | 1.4 | 1.4 |
| A、用Y来表示0-4min的平均反应速率为0.15mol/(L?min) |
| B、该温度下反应的化学平衡常数为18.15 |
| C、向平衡体系中再加入2molX和1mol Y,达到新的平衡时X的体积分数增大 |
| D、对平衡体系降低温度,化学反应后速率减慢,但Y的转化率增大 |
| △c |
| △t |
| △c |
| △t |
| 1.2mol/L |
| 4min |
| 1 |
| 2 |
| 1 |
| 2 |
| 1.42 |
| 0.62×0.3 |


科目:高中化学 来源: 题型:
| A、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Clˉ)>c(NH4+)>c(H+)=c(OHˉ) | ||
| B、在0.1mol?L-1 的NaHA溶液pH=4,则H2A为强酸 | ||
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊呈红色 | ||
D、向0.1mol?L-1的氨水中加少量硫酸铵固体,则溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
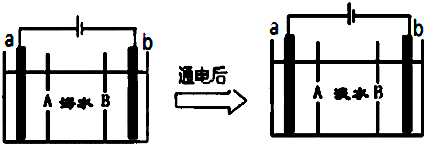
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13.6g |
| B、12g |
| C、6g |
| D、3.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=4的醋酸中:c(H+)=4.0mol?L-1 |
| B、pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
| C、饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D、饱和小苏打溶液中:c(Na+)=c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
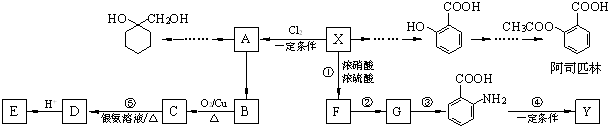
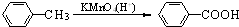
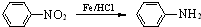 (苯胺,易被氧化)
(苯胺,易被氧化)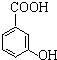 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: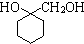 的流程图:
的流程图: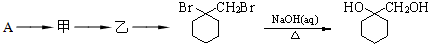 完成甲→乙的化学反应方程式:
完成甲→乙的化学反应方程式: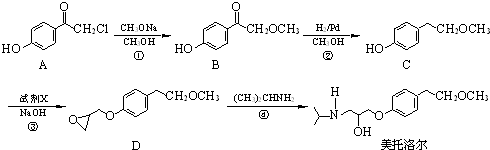
 为原料
为原料 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com