
下列离子方程式正确的是( )
A.三氯化铁溶液中加入铁:Fe3++Fe===2Fe2+
B.氯化镁溶液中加入硝酸银溶液:Ag++Cl-===AgCl↓
C.过量氯气通入氯化亚铁溶液中:Fe2++Cl2===Fe3++2Cl-
D.氢氧化铜溶于稀硫酸中:OH-+H+===H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
为了净化和收集由盐酸和大理石制得的CO2气体,从下图中选择合适的装置并连接。合理的是( )
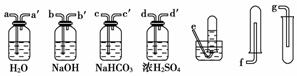
A.a—a′→d—d′→e B.b—b′→d—d′→g
C.c—c′→d—d′→g D.d—d′→c—c′→f
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.含最高价元素的化合物,一定具有强氧化性
B.阳离子只有氧化性,阴离子只有还原性
C.失电子越多,还原性越强
D.强氧化剂与强还原剂不一定能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
足量的锌和下列酸反应,产生H2的物质的量最多的是( )
A.10 mL 18.4 mol·L-1 H2SO4
B.30 mL 3 mol·L-1盐酸
C.30 mL 2 mol·L-1 H2SO4
D.30 mL 5 mol·L-1 HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
我国农业生产因遭受酸雨而造成的损失每年高达15亿元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区划分方案》等法规。
(1)某实验小组采集酸雨样品,随着时间的推移,多次测定该样品pH,得到了如下数据:
| 时间(t) | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
简答:
①酸雨样品放置时pH变化的主要原因(用化学方程式表示):____________________。
②如果将刚取样的上述酸雨和自来水混合,pH将______(“增大”、“减小”或“不变”),原因是(用化学方程式表示)_______________________________________。
(2)酸雨可导致下列哪些危害( )
A.腐蚀建筑物 B.导致树木枯萎
C.造成洪涝灾害 D.恶化人类环境
(3)你认为减少酸雨产生的途径可采取的下列措施是( )
①少用煤作燃料 ②把工厂的烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤
(4)为了防治酸雨,减少煤燃烧时向大气排放的二氧化硫,火力发电厂常用Ca(OH)2的悬浊液吸收煤燃烧时产生的二氧化硫气体,并回收,制成有用的石膏CaSO4·2H2O,则有关反应的化学方程式:___________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
印刷铜制线路板的“腐蚀液”为FeCl3溶液。已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3===2FeCl2+CuCl2,Fe+2FeCl3===3FeCl2。现将一铜、铁混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说法正确的是( )
A.溶液中一定含FeCl3,固体一定是铁和铜
B.溶液中一定含FeCl2,固体一定含铜
C.溶液中一定含FeCl2、CuCl2,固体一定含铜
D.溶液中一定含FeCl2,固体一定是铁和铜
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是镁的主要来源之一。从海水中提取镁可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应、结晶、过滤、干燥产物;④电解;⑤得到产物。下列关于提取镁的说法中,不正确的是( )
A.此法的优点之一是原料取自大海
B.进行①②③步骤的目的是富集MgCl2
C.可用电解熔融氧化镁的方法制取镁
D.电解法冶炼金属要消耗大量电能
查看答案和解析>>
科目:高中化学 来源: 题型:
1.52g铜镁合金完全溶解于50mL密
度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是 。
(2)NO2和N2O4的混合气体中,NO2的体积分数是 。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com