
| A、热水瓶胆中的水垢可以用食醋除去 |
| B、可以用淀粉溶液检验加碘盐中是否含碘元素 |
| C、漂白粉可用于自来水的杀菌、消毒 |
| D、做红烧鱼时,常加一些食醋和酒会更香,是因为生成少量的酯 |


科目:高中化学 来源: 题型:
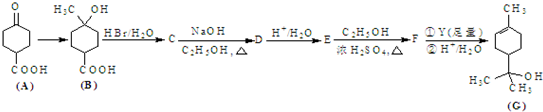
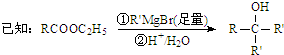
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在做金属钠的有关实验时,将取多了的金属钠放回原试剂瓶 |
| B、四氯化碳是一种不溶于水的有机溶剂,用它可以从碘水中萃取碘,分液时,应从分液漏斗下端 将碘的四氯化碳溶液放出,然后用蒸馏的方法将碘与四氯化碳分离 |
| C、进行焰色反应实验前,铂丝应先用硫酸洗净,再用酒精灯外焰灼烧至没有颜色 |
| D、在做NaHCO3固体受热分解的实验时,反应完后应先将导气管从澄清石灰水中移出,再停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 试验方法 |
| 除去Na2CO3固体中少量的NaHCO3 | |
| 证明纯碱溶液显碱性 | |
| 检验酒精中是否含有水 | |
| 检验氯化亚铁是否变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、P(H2)=P(O2)=P(N2) |
| B、P(O2)>P(N2)>P(H2) |
| C、P(H2)>P(N2)>P(O2) |
| D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1所示的总反应为吸热反应 |
| B、图2表示常温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 |
| C、图3表示反应CO(g)+2H2(g)?CH3OH(g)平衡常数K随CO浓度变化的关系 |
| D、图4可以说明在恒容密闭容器中充入SO2、O2,反应2SO2(g)+O2(g)═2SO3(g) 从t1时刻起达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 锰及其化合物在现代工业及国防建设中具有十分重要的地位.
锰及其化合物在现代工业及国防建设中具有十分重要的地位.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com