
【题目】设NA为阿伏加德罗常数的数值,下列叙述正确的是( )
A. 标准状况下,5.6LHF中含有电子数为2.5NA
B. 50g质量分数为46%的乙醇溶液中,氢原子的总数为3NA
C. 1 molNa2O2固体中含阴离子总数为2NA
D. 0.1 molH2和0.1 mol I2 于密闭容器中充分反应,其分子总数为 0.2 NA
【答案】D
【解析】A、标准状况下HF为固态物质,不适用气体摩尔体积的有关计算,A错误;B、乙醇的物质的量n=50g×46%/46gmol-1=0.5mol,水的物质的量为n=50g×54%/18 gmol-1=1.5mol,所以氢原子的总的物质的量n(H)=0.5mol×6+1.5mol ×2=6mol,氢原子的总数为6NA,B错误;C、Na2O2中的阴离子为O22-,所以1 molNa2O2固体中含阴离子总数为NA,C错误;D、H2(g)+I2(g) ![]() 2HI(g),反应前后气体分子个数不变,所以0.1 molH2和0.1 mol I2 于密闭容器中充分反应,其分子总数为 0.2 NA,D正确。正确答案为D。
2HI(g),反应前后气体分子个数不变,所以0.1 molH2和0.1 mol I2 于密闭容器中充分反应,其分子总数为 0.2 NA,D正确。正确答案为D。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】在100mL H2SO4与CuSO4的混合液中,用石墨作电极电解,两极上均收集到2.24L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
A.0.5 mol/L
B.1 mol/L
C.3 mol/L
D.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为VL的恒容密闭容器中盛有一定量H2 , 通入Br2(g)发生反应:H2(g)+Br2(g) ![]() 2HBr(g) △H<0。当温度分别为T1、T2平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是( )
2HBr(g) △H<0。当温度分别为T1、T2平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是( )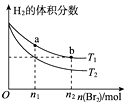
A.由图可知:T2>T1
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号内试剂除去下列各物质中的少量杂质,正确的是( )
A.溴苯中的溴(苯)
B.甲烷中的乙烯(溴水)
C.乙醇中的水(金属钠)
D.甲烷中的乙烯(酸性高锰酸钾溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述正确的是
A.氧化还原反应的本质是元素化合价发生变化
B.物质所含元素化合价降低的反应是氧化反应
C.置换反应一定属于氧化还原反应
D.化合反应和分解反应不可能是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾假单胞菌株能够在分解有机物的同时分泌物质产生电能,其原理如下图所示。下列说法正确的是( )
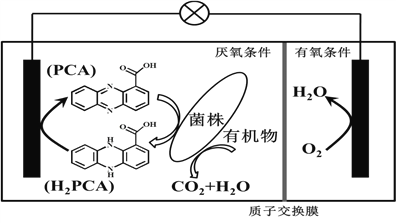
A. 电流由左侧电极经过负载后流向右侧电极
B. 放电过程中,正极附近pH 变小
C. 若1molO2 参与电极反应,有4 mol H+穿过质子交换膜进入右室
D. 负极电极反应为:H2PCA + 2e-=PCA + 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下图所示,下列说法不正确的是
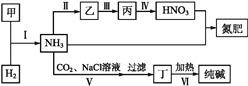
A. 甲、乙、丙三种物质中都含有氮元素
B. 反应Ⅰ、Ⅱ、Ⅲ中含氮元素的反应物都被氧化
C. Ⅴ中发生反应:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
D. Ⅵ利用丁物质受热易分解的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图1所示。放电时总反应为Zn+2H2O+2MnO2![]() Zn(OH)2+2MnOOH,从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下图2所示:
Zn(OH)2+2MnOOH,从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下图2所示:
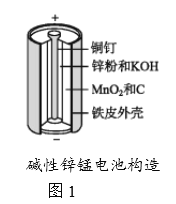
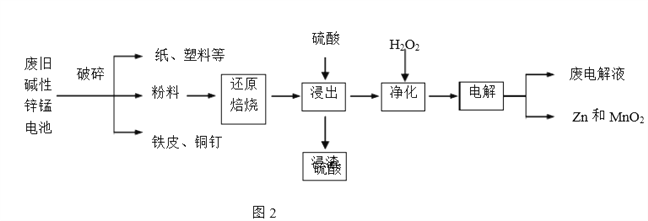
回答下列问题:
(1)碱性锌锰电池中,锌粉、MnO2、KOH的作用分别是(每空只选1个)_______、_______ 、______。
a.正极反应物b. 正极材料 c.负极反应物
d. 负极材料 e. 电子导体 f. 离子导体
(2)“还原焙烧”过程中,无需外加还原剂即可在焙烧过程中将MnOOH、MnO2还原为MnO,起还原作用的物质是___________。
(3)“净化”是在浸出液中先加入H2O2,再加入碱调节溶液pH到4.5左右,再过滤出沉淀。请完整说明这样操作的目的是______________。
Zn(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀的pH | 5.5 | 1.9 | 8.0 |
沉淀完全的pH | 8.0 | 3.2 | 10.0 |
(4) “电解”时,阳极的电极反应式为___。本工艺中应循环利用的物质是____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为_____。
(6)某碱性锌锰电池维持电流0.5 A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有____%的金属锌未参加反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com