
| A. | 90和18 | B. | 88和20 | C. | 90和20 | D. | 88和18 |
分析 乙酸与乙醇反应中,乙酸提供羟基,醇提供羟基氢原子,结合生成水,其余部分互相结合成酯,发生反应为CH3COOH+CH3CH218OH?CH3CO18OCH2CH3+H2O,据此判断生成物乙酸乙酯和水的分子量.
解答 解:酯化反应中酸提供羟基,醇提供羟基氢原子,结合生成水,其余部分互相结合成酯,所以乙酸与乙醇反应方程式为:CH3COOH+CH3CH218OH?CH3CO18OCH2CH3+H2O,则生成物乙酸乙酯和水的分子量分别为:90、18,
故选A.
点评 本题考查酯化反应的原理与特点,难度不大,注意羧酸跟醇的酯化反应是可逆的,羧酸跟醇的反应过程一般是:羧酸分子中的羟基与醇分子中羟基的氢原子结合成水,其余部分互相结合成酯.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
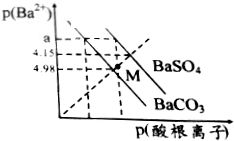 已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )
已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )| A. | p(Ba2+)=a时,溶液中所含的c(SO42-)>c(CO32-) | |
| B. | M点对应溶液中的Ba2+、CO32-能形成BaCO3沉淀 | |
| C. | 由图可知该温度下,KSP(BaSO4)<KSP(BaCO3) | |
| D. | BaSO4淀不能转化为BaCO3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(Ca2+)增大 | B. | c(Ca2+)不变 | C. | n(OH-)增大 | D. | c(OH-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
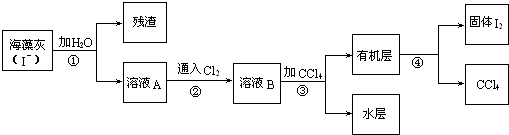
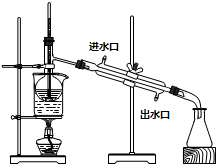
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
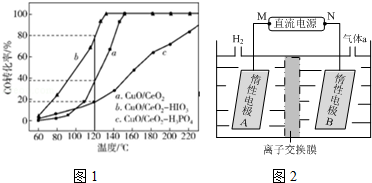
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的量浓度保持不变 | B. | 各物质的量浓度相等 | ||
| C. | V逆=V正,正逆反应停止 | D. | N2、H2、NH3的速率相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com