
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、![]() 、
、![]() 、
、![]() 、
、![]() 、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是( )
、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是( )
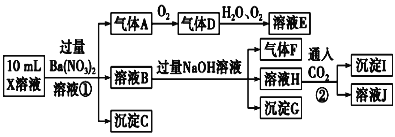
A.气体A是NO2
B.X溶液中肯定存在Fe2+、Al3+、![]() 、
、![]()
C.溶液E和气体F不能发生化学反应
D.X溶液中不能确定的离子是Al3+和Cl-
【答案】D
【解析】
强酸性溶液,一定不含![]() 、
、![]() ;加入硝酸钡,有白色沉淀生成,说明一定含有
;加入硝酸钡,有白色沉淀生成,说明一定含有![]() ;加入硝酸钡,有气体生成,说明一定含有还原性离子Fe2+,生成的气体A是NO,D是NO2,E是HNO3;溶液B一定含有Fe3+、Ba2+,加入氢氧化钠生成沉淀Fe(OH)3,同时生成气体F,F是NH3,说明原溶液含有
;加入硝酸钡,有气体生成,说明一定含有还原性离子Fe2+,生成的气体A是NO,D是NO2,E是HNO3;溶液B一定含有Fe3+、Ba2+,加入氢氧化钠生成沉淀Fe(OH)3,同时生成气体F,F是NH3,说明原溶液含有![]() ;溶液H一定含有Ba2+,通入二氧化碳气体,生成沉淀I,则I是碳酸钡或碳酸钡和Al(OH)3的混合物,则原溶液可能含有Al3+。
;溶液H一定含有Ba2+,通入二氧化碳气体,生成沉淀I,则I是碳酸钡或碳酸钡和Al(OH)3的混合物,则原溶液可能含有Al3+。
根据分析,A. 气体A是NO,故A错误;
B. X溶液中可能含有Al3+,故B错误;
C. 溶液E是硝酸、气体F是氨气,发生反应生成硝酸铵,故C错误;
D. X溶液中一定有Fe2+、![]() 、
、![]() ,一定不含
,一定不含![]() 、
、![]() ,不能确定的离子是Al3+和Cl-,故D正确。
,不能确定的离子是Al3+和Cl-,故D正确。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献.联合制碱法的主要过程如图所示(部分物质己略去)

(1)①~③所涉及的操作方法中,包含过滤的是________(填序号)
(2)根据上图,写出①中发生反应的化学方程式:________
(3)煅烧![]() 固体的化学方程式是_____________
固体的化学方程式是_____________
(4)下列说法中,正确的是________(填字母)
a.![]() 可循环使用
可循环使用
b.副产物![]() 可用作肥料
可用作肥料
c.溶液B中一定含有![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饱和BaCO3溶液中存在平衡:BaCO3(s)![]() Ba2+(aq)+CO32-(aq)。当碳酸钡固体在水中达到溶解平衡后,为使溶液中Ba2+的物质的量浓度增大,下列操作不可行的是
Ba2+(aq)+CO32-(aq)。当碳酸钡固体在水中达到溶解平衡后,为使溶液中Ba2+的物质的量浓度增大,下列操作不可行的是
A.加入少量0.1 mol·L-1盐酸B.加入少量硝酸钡固体
C.加入少量0.1 mol·L-1硫酸D.加入少量氢氧化钡固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
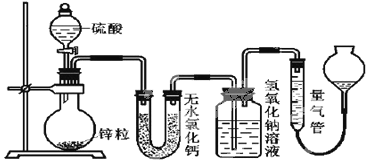
(1)若在烧瓶中放入1.30g锌粒,与cmol/LH2SO4反应,为保证实验结论的可靠,量气管的适宜规格是__。
A.200mL B.400mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g,则圆底烧瓶中发生反应的化学方程式为:__。
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重bg。量气瓶中收集到VmL气体,则有:![]() ,依据的原理是___。
,依据的原理是___。
(4)若在烧瓶中投入dg锌,加入一定量的cmol/L浓硫酸VL,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,![]() =__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,
=__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,![]() 的数值将__(填偏大、偏小或无影响)。
的数值将__(填偏大、偏小或无影响)。
(5)反应结束后,为了准确地测量气体体积,除了待冷却至室温才开始读数外,量气管在读数时还应注意:①___;②___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对如图所示乙醇分子结构,下述关于乙醇在各种化学反应中化学键断裂情况的说法不正确的( )
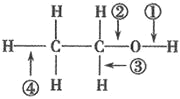
A.与金属钠反应时,①键断裂
B.与浓硫酸共热至170℃时,②、④键断裂
C.在 Ag 催化下与O2反应时,①、③键断裂
D.与醋酸、浓硫酸共热时,②键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验。请回答下列问题:
(1)酸碱中和滴定——用浓度为0.1000mol·L-1的标准盐酸滴定未知浓度的NaOH溶液,表格中记录了实验数据:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.50 | 20.40 |
第二次 | 20.00 | 3.00 | 23.00 |
第三次 | 20.00 | 4.00 | 24.10 |
①下列操作造成测定结果偏高的是________(填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
②该NaOH溶液的物质的量浓度为_____________mol/L。(小数点后保留四位有效数字)
(2)氧化还原滴定——取一定量的草酸(H2C2O4)溶液置于锥形瓶中,加入适量稀硫酸,用标准酸性高锰酸钾溶液滴定。滴定时KMnO4溶液应装在______________(填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是_________________________________。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是______(填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaClB.NaBrC.NaCND.Na2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )

A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)苯氯乙酮是一具有荷花香味且有强催泪作用的化学试剂,它的结构简式如图所示![]() ,则苯氯乙酮不可能具有的化学性质是___(填字母序号)。
,则苯氯乙酮不可能具有的化学性质是___(填字母序号)。
a.加成反应 b.取代反应 C.消去反应d.水解反应 e.银镜反应 f.还原反应
(2)由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
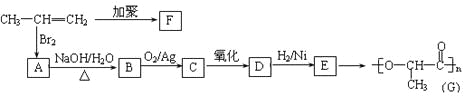
①聚合物F的结构简式:_________________________________________。
②c与新制的Cu(OH)2碱性悬浊液共热转化为D的化学方程式是:________________。
③在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质检验、分离、提纯和制备是化学实验中的常见操作。
(1)除去FeCl3溶液中混有的FeCl2可采取的方法是______(用离子方程式表示)。
(2)检验食盐中所含阳离子的实验操作名称是_________。
(3)检验Fe2(SO4)3溶液中是否含有FeSO4所用试剂是_________。
(4)实验室制备氯气的化学反应方程式为_______,请在方程式中标出电子转移的方向和数目。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com