
| A. | c(OH-) | B. | Kh(Na2S) | C. | $\frac{c({H}^{+})}{c({S}^{2-})}$ | D. | $\frac{c(N{a}^{+})}{c({S}^{2-})}$ |
分析 Na2S是强碱弱酸盐,存在S2-+H2O?HS-+OH-水解平衡,加水不断稀释,促进水解,但溶液的体积变大,由此分析解答.
解答 解:Na2S是强碱弱酸盐,存在S2-+H2O?HS-+OH-水解平衡,加水不断稀释,促进水解,但溶液的体积变大,
A、加水不断稀释,促进水解,氢氧根离子的物质的量增大,但溶液的体积变大占主导,所以c(OH-)终保持减小,故A正确;
B、Kh(Na2S)是温度的函数,温度不变,Kh(Na2S)不变,故B错误;
C、溶液中氢离子浓度变化不大,而加水稀释硫离子浓度减小,所以$\frac{c({H}^{+})}{c({S}^{2-})}$的比值增大,故C错误;
D、$\frac{c(N{a}^{+})}{c({S}^{2-})}$等于物质的量之比,加水稀释钠离子的物质的量不变,而硫离子物质的量减小,所以两者的比值增大,故D错误;
故选A.
点评 本题考查学生影响水解平衡移动的因素知识,注意平衡移动原理的应用是关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 13C和14C属于同一种元素,它们互为同位素 | |
| B. | LiH、LiD、LiT的摩尔质量之比为8:9:10 | |
| C. | 两原子如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 对于可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时C的百分含量与温度(T)和压强(P)关系如图所示,下面叙述正确的是( )
对于可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时C的百分含量与温度(T)和压强(P)关系如图所示,下面叙述正确的是( )| A. | 使用催化剂,C的百分含量增大 | |
| B. | 升温,化学平衡向正反应方向移动 | |
| C. | 化学方程式的化学计量数关系m+n>e+f | |
| D. | 该反应是一个放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④ | B. | ③ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
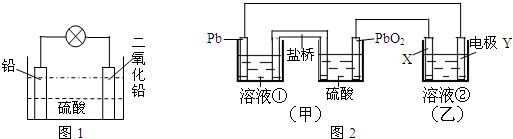
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知常温下0.1 mol.L -1NaCN溶液的pH=12,则已水解的CN -约占总数的10% | |
| B. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离常数K(NH 3.H 2O)>K(HCN) | |
| C. | NH4ClO4溶液中,c(ClO4-)>c (NH4+)>c(OH -)>?c(H +)? | |
| D. | 欲使0.1 mol•L-1Na2S溶液中$\frac{c(Na)^{+}}{c({S}^{2-})}$更接近2,可加入适量KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
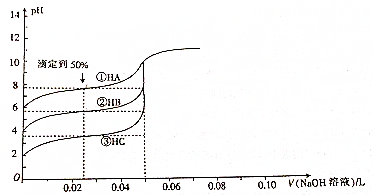
| A. | Ka(HA)>Ka(HB)>Ka(HC) | |
| B. | 滴定到50%时,溶液中:c(A-)>(B-)>(C-) | |
| C. | V(NaOH)溶液=50mL时,溶液中水的电离程度:①>②>③ | |
| D. | V(NaOH)溶液=50mL时,溶液pH的大小关系:pH(A)<pH(B)<pH(C) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com