
【题目】(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式_____________ ;
(2)用如图所示装置可检验木炭和浓硫酸反应产生的混合气体中含有SO2和CO2。
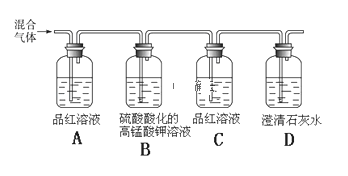
①能够证明混合气体中含有SO2的实验现象是:________________________________;
②设计B、C的实验目的是:________________________________________________;
③写出B中发生反应的离子方程式:_____________________________;
④能够证明混合气体中含有CO2的实验现象是:_____________________。
【答案】2H2SO4(浓)+C![]() CO2↑+SO2↑+2H2O A中品红溶液褪色 除去SO2并检验SO2,气体是否除尽,排除SO2对CO2气体检验的干扰 5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+ C中品红溶液不褪色D中溶液变浑浊
CO2↑+SO2↑+2H2O A中品红溶液褪色 除去SO2并检验SO2,气体是否除尽,排除SO2对CO2气体检验的干扰 5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+ C中品红溶液不褪色D中溶液变浑浊
【解析】
根据碳和硫酸反应生成二氧化硫、二氧化碳和水分析,二氧化硫能使品红褪色,但二氧化碳不能,二氧化碳能使澄清石灰水反应变浑浊,二氧化硫也能,故先检验二氧化硫并除去,后检验二氧化碳。
(1)碳和浓硫酸反应生成二氧化硫和二氧化碳和水,方程式为2H2SO4(浓)+C![]() CO2↑+SO2↑+2H2O;
CO2↑+SO2↑+2H2O;
(2)①二氧化硫能使品红褪色,故A中品红溶液褪色;
②因为二氧化硫也能使澄清石灰水变浑浊,故先除去SO2并检验SO2气体是否除尽,排除SO2对CO2气体检验的干扰;
③二氧化硫能被高锰酸钾氧化,离子方程式为:5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+;
④二氧化硫完全除去后才能根据澄清石灰水的现象分析,故能够证明混合气体中含有CO2的实验现象是:C中品红溶液不褪色D中溶液变浑浊。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】在冶金工业中,常以C作为还原剂,如温度高于980 K时,氧化产物以CO为主,低于980 K时以CO2为主。
(1)已知2CO(g)![]() CO2(g)+C(s),T=980 K时ΔH-TΔS=0。当体系温度低于980 K时,估计ΔH-TΔS________0(选填“大于”、“小于”或“等于”);当体系温度高于980 K时,该反应________自发进行(填“能”或“不能”)。
CO2(g)+C(s),T=980 K时ΔH-TΔS=0。当体系温度低于980 K时,估计ΔH-TΔS________0(选填“大于”、“小于”或“等于”);当体系温度高于980 K时,该反应________自发进行(填“能”或“不能”)。
(2)电子工业中清洗硅片上的SiO2(s)的反应为:
SiO2(s)+4HF(g)===SiF4(g)+2H2O(g)
ΔH(298.15 K)=-94.0 kJ·mol-1
ΔS(298.15 K)=-75.8 J·mol-1·K-1。
设ΔH和ΔS不随温度变化而变化,则此反应自发进行的温度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。则下列说法正确的是( )
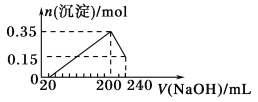
A.Mg和Al的总质量为8 g
B.原稀硫酸溶液的物质的量浓度为5 mol·L-1
C.生成的H2在标准状况下的体积为11.2 L
D.NaOH溶液的物质的量浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A.原子序数:Y>X>Z>WB.离子半径:X+>Y2+>Z->W2-
C.原子最外层电子数:Z>W>Y>XD.还原性:X>Y,W2->Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)实验室在配制 FeSO4溶液时为了防止 FeSO4溶液变质,经常向其中加入铁粉,其原因是______________(用离子方程式表示)。
(2)向FeSO4溶液中滴加氨水的现象为 ______________________,请用化学用语解释出现此现象的原因___________________;_____________________
(3)现有配制所得的 100mL 6mol/L FeSO4溶液,往其中滴入一定量稀硝酸,请回答下列问题:
①配平该反应的离子方程式:____Fe2+____NO3-+____H+ = ___Fe3++____NO↑+_____H2O(在横线上写上化学计量数)
②要检验该反应后的溶液中是否还含有 Fe2+,可选用下列的一种试剂为_______
A.酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③写出上述②的具体实验方案(含操作、现象、结论):____________________。
④经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)____________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第三、四周期的某些元素在生产、生活中有着广泛的应用。
(1)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
①钒的价电子排布图是___________;
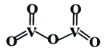
②V2O5是一种常见的催化剂,常用在SO2转化为SO3的反应中。V2O5的结构式如图所示,则V2O5分子中σ键和π键数目之比为____________;若将V2O5溶解在NaOH溶液中,可得到锐酸钠(Na3VO4),该盐中阴离子的立体构型为_____________,写出与VO43-空间构型相同的一种阳离子____________(填化学式)。
(2)氯化铝在有机化学中有很广泛的应用。无水氯化铝在177.8℃时升华,蒸气或熔融状态以Al2Cl6形式存在。下列关于氯化铝的推断错误的是_______。
a.氯化铝是分子晶体 b.Al2Cl6中Al是sp2杂化
c.氯化铝难溶于有机溶剂 d.Al2Cl6中存在配位键
(3)FeCO3可作补血剂,CoCO3可用于陶瓷工业的着色剂。已知:r(Fe2+)为61pm,r(Co2+)为65pmo在隔绝空气条件下分别加热FeCO3和CoCO3时,FeCO3的分解温度低于CoCO3,其原因是_________________________。
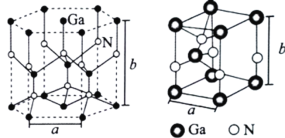
(4)GaN是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaN晶胞结构如图所示。已知六棱柱底边边长为acm,高为bcm,阿伏加德罗常数的值为NA。则晶胞中Ga原子采用的密堆积方式为______________,每个Ga原子周围距离最近的Ga原子数目为____;GaN的密度为_____________gem-3(用含a、b、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A. 以X浓度变化表示的反应速率为0.001 mol·L-1·s-1
B. X和Y的转化率相等
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com