
| A. | 反应的△H>0 | B. | 降低温度,平衡向逆反应方向移动 | ||
| C. | 反应的△H<0 | D. | 升高温度,平衡向正反应方向移动 |
科目:高中化学 来源: 题型:选择题
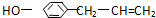 从它的结构简式可推测它不可能有的化学性质是( )
从它的结构简式可推测它不可能有的化学性质是( )| A. | 既可燃烧,也可使酸性KMnO4溶液褪色 | |
| B. | 可与NaHCO3溶液反应放出CO2气体 | |
| C. | 可与FeCl3溶液发生显色反应 | |
| D. | 既可与Br2发生加成反应又可发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟氯烃作制冷剂会加剧雾霾天气的形成 | |
| B. | 只通过电解的方法就能实现从食盐水到“84”消毒液的生产 | |
| C. | 加碘食盐中含有碘元素,能使淀粉溶液变蓝 | |
| D. | 工业上制漂白粉,所得的氯化物都具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
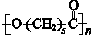 . 其合成路线如下.
. 其合成路线如下.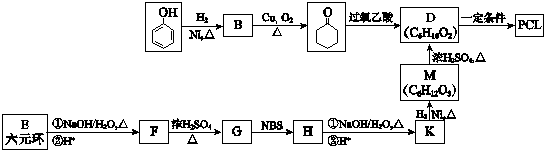
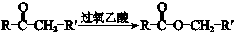
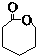 .
.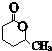 .
.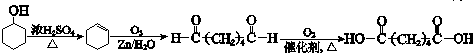 .
.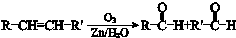 合成路线流程图示例:
合成路线流程图示例: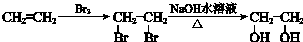
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 煤的主要成分是焦炭和无机物杂质 | |
| B. | 乙烯和苯都能使溴水褪色 | |
| C. | 利用点燃的方法可以鉴别甲烷和乙烯 | |
| D. | 油脂、葡萄糖、蛋白质都可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用如图所示装置制取乙烯.
实验室用如图所示装置制取乙烯.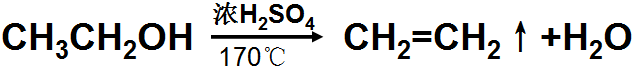
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com