
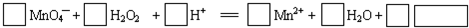
分析 由给出方程式可知,反应物中高锰酸钾有强氧化性,能将双氧水氧化为氧气,所以方程式中缺少的物质是O2,锰元素化合价由+7价降到+2价,降低了5价,双氧水中的氧元素从-1价升高到0价,依据氧化还原反应得失电子守恒规律及原子个数守恒规律配平方程式,据此解答.
解答 解:高锰酸钾有强氧化性,能将双氧水氧化为氧气,所以方程式中缺少的物质是O2,锰元素化合价由+7价降到+2价,降低了5价,双氧水中的氧元素从-1价升高到0价,生成1mol氧气时,氧元素化合价升高2价,根据氧化还原反应得失电子守恒规律,配平化学方程式高锰酸根前面的系数为2,双氧水前面的系数为5,根据原子守恒来配平其他物质前面的系数,该反应的化学方程式为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2,
故答案为:2;5;6;2;8;502.
点评 本题考查了氧化还原方程式的书写,明确氧化还原反应中得失电子守恒规律及原子个数守恒规律是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 反应的热化学方程式可表示为:CO(g)+H2O(g)$?_{高温高压}^{催化剂}$CO2(g)+H2(g)△H<0 kJ/mol | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应的正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| B. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| D. | 正、逆反应速率都没有变化,平衡不发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+,Ca2+,HCO3-,OH- | B. | K+,NH4+,S2-,OH- | ||
| C. | Mg2+,K+,HSO3-,H+ | D. | K+,Na+,NO3-,CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
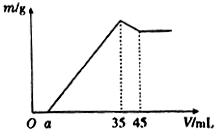 准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )
准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10mol•L-l的NaoH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示,则所用硫酸溶液的物质的量浓度为( )| A. | 3.50mol/L | B. | 1.75mol/L | C. | 0.85mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 | |
| B. | 铵盐受热易分解 | |
| C. | 0.1 mol/L氨水可以使酚酞试液变红 | |
| D. | 常温下,0.1 mol/L氨水的pH约为9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com