
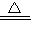 Mn 2++Cl2↑+2H2O,
Mn 2++Cl2↑+2H2O, Mn 2++Cl2↑+2H2O;
Mn 2++Cl2↑+2H2O;

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
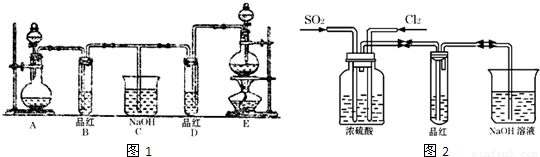
(18分)某化学实验小组同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置:
(1)用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是 。
(2)实验室用装置E制备Cl2,该反应的化学方程式为 ,若反应中有1 mol的HCl被氧化,则反应中转移的电子总数为___ _______。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B ;
D 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:
B ;
D 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示): 。
(5)SO2和Cl2均属于大气污染物,需要进行尾气处理(用装置C),则在装置C中的试剂是______________(填名称),请写出SO2和Cl2分别与该试剂反应的离子方程式 ,
。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省忻州一中高一上学期期末联考化学试卷(B)(带解析) 题型:实验题
(18分)某化学实验小组同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置: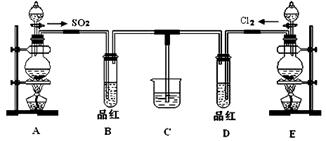
(1)用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是 。
(2)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B ;D 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:
B ;D 。
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示): 。
(4)SO2和Cl2均属于大气污染物,需要进行尾气处理(用装置C),则在装置C中的试剂是_____(填名称),请写出SO2和Cl2分别与该试剂反应的离子方程式 , 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年甘肃兰州一中高一上学期期末考试化学试卷 题型:实验题
(18分)某化学实验小组同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置: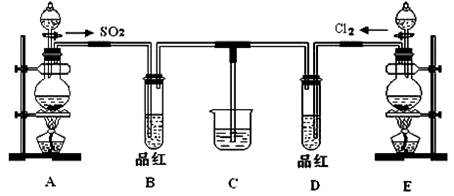
(1)用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是 。
(2)实验室用装置E制备Cl2,该反应的化学方程式为 ,若反应中有1 mol的HCl被氧化,则反应中转移的电子总数为___ _______。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B ;
D 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:
B ;
D 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示): 。
(5)SO2和Cl2均属于大气污染物,需要进行尾气处理(用装置C),则在装置C中的试剂是______________(填名称),请写出SO2和Cl2分别与该试剂反应的离子方程式 ,
。
查看答案和解析>>
科目:高中化学 来源:2015届山西省高一上学期期末联考化学试卷(B)(解析版) 题型:实验题
(18分)某化学实验小组同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置:
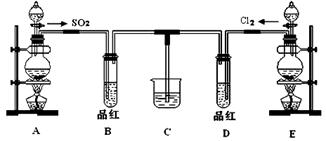
(1)用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是 。
(2)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B ;D 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:
B ;D 。
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示): 。
(4)SO2和Cl2均属于大气污染物,需要进行尾气处理(用装置C),则在装置C中的试剂是_____(填名称),请写出SO2和Cl2分别与该试剂反应的离子方程式 , 。
查看答案和解析>>
科目:高中化学 来源:2014届甘肃兰州一中高一上学期期末考试化学试卷 题型:实验题
(18分)某化学实验小组同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置:
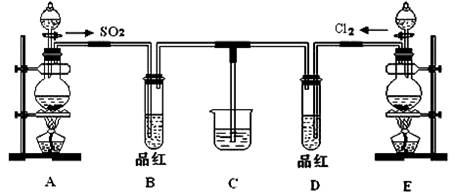
(1)用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是 。
(2)实验室用装置E制备Cl2,该反应的化学方程式为 ,若反应中有1 mol的HCl被氧化,则反应中转移的电子总数为___ _______。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B ;
D 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:
B ;
D 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示): 。
(5)SO2和Cl2均属于大气污染物,需要进行尾气处理(用装置C),则在装置C中的试剂是______________(填名称),请写出SO2和Cl2分别与该试剂反应的离子方程式 ,
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com