
【题目】下列有关同分异构体的叙述中,正确的是( )
A.甲苯苯环上的一个氢原子被3个碳原子的烷基取代,所得产物有3种
B.含有5个碳原子的饱和链烃,其一氯代物有8种
C.菲的结构简为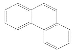 ,它与硝酸反应可生成5种一硝基取代物
,它与硝酸反应可生成5种一硝基取代物
D.2-氯丁烷与NaOH的水溶液共热发生反应,可生成2种有机物
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)“民以食为天,食以安为先”。近年来屡屡发生的 劣质奶粉、苏丹红、多宝鱼等食品安全事件严重威胁消费者的健康和生命安全。下列有关蛋白质的说法正确的是____________(填序号)。
A.蛋内质是重要的营养物质,也是提供人体所需能最的主要物质
B.蛋白质在淀粉酶的作用下,可水解成葡萄糖等
C.蛋白质水解的最终产物是氨基酸
(2)奶粉中蛋内质含量的国家标准是:每100 g婴幼儿奶粉中含蛋白质1225 g。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨, 由氨的量计算出氮的量,再由氮的量求出蛋白质的含量(蛋白质含氮量按16%计算)。某市质检局取100 g市场中的某个品牌的奶粉样品进行检验。该样品进行反应后生成的![]() 和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
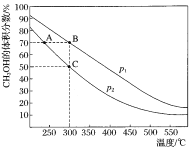
A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是
A. 已知甲烷的燃烧热为890.3 kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJmol-1
B. 已知强酸和强碱的稀溶液反应的中和热为57.3 kJmol-1,则CH3COOH+OH—=CH3COO—+H2O ΔH=-57.3 kJmol-1
C. 一定条件下,将0.5mol N2和1.5mol H2置于密闭容器中,充分反应生成NH3(g),放出热量19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJmol-1
2NH3(g) ΔH=-38.6 kJmol-1
D. 已知1g N2H4(l)和足量H2O2(l)反应生成氮气和水蒸气,放出热量20.05kJ,该热化学方程式可表示为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法错误的是

A. 电极Y应为Li
B. X极反应式为FeS+2Li++2e-=Fe+Li2S
C. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KA1(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。采用废易拉罐制备明矾的过程如下图所示。
下列叙述错误的是
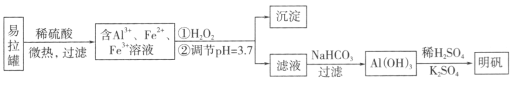
A. 合理处理易拉罐有利于环境保护和资源再利用
B. 从易拉罐中可回收的金属元素有Al、Fe
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用NaHSO4代替NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W是原子序数依次增大的前四周期元素,X元素有1个2p空轨道,Y为同周期离子半径最小的金属元素;Z元素原子的最外层电子数比次外层电子数少2;M原子外围电子排布式为3dn4sn;W的内层电子已全充满,最外层只有2个电子。
请回答下列问题:
⑴M元素名称___,W元素在周期表中位置___。
⑵写出W元素基态原子的价电子排布图___,画出Y的原子结构示意图___。
⑶元素Z的最高价氧化物中,Z原子的杂化方式是___,分子的空间构型是___,属于___分子(填“极性”或“非极性”)。
⑷X能与氢、氮、氧三种元素构成化合物XO(NH2)2,该化合物分子中的σ键与π键的个数之比是___。
⑸Y的氯化物气态时通常以二聚分子形式存在,分子式为Y2Cl6,分子中所有原子均达到8电子稳定结构,则Y2Cl6的结构式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇来源丰富,有广泛的用途和广阔的应用前景,工业上可以利用CO和CO2生产甲醇,同时可以利用甲醇生产丙烯。制备甲醇,丙烯过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.0kJ/mol
CH3OH(g) △H3=-90.0kJ/mol
反应Ⅳ:3CH3OH(g)![]() C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
回答下列问题:
(1)反应Ⅱ的ΔH2=________。
(2)反应Ⅲ能够自发进行的条件是________(填“较低温度”“较高温度”或“任何温度”),据研究该反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于保持催化剂Cu2O的量不变,原因是________(用化学方程式表示)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2的生成速率与CH3OH的生成速率相等
D.容器的压强不再变化
(4)甲醇生产丙烯的同时,还生成乙烯。在某催化剂作用下,2L密闭容器中加入0.5mol甲醇,经过相同时间后测得甲醇转化率及丙烯的选择性(生成丙烯的甲醇与甲醇转化量的比值)与反应温度之间的关系如图所示。计算600℃时反应甲醇生产丙烯的反应Ⅳ平衡常数________。若将容器体积压缩为1L,其他条件不变,在如图中作出甲醇平衡转化率随温度的变化曲线。________。
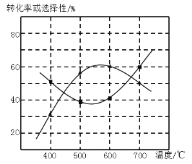
(5)研究表明,甲醇可由CO2在强酸性水溶液中通过电解合成,则生成甲醇的反应电极反应式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)称取A4.5g,升温使其汽化,测其密度是相同条件下H2的45倍。 | (1)A的相对分子质量为:___。 |
(2)将此4.5g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g。 | (2)A的分子式为:____。 |
(3)另取A 4.5g,跟足量的NaHCO3粉末反应,生成1.12L CO2(标准状况),若与足量金属钠反应则生成1.12L H2(标准状况)。 | (3)写出A中含有的官能团(用结构简式表示)____。 |
(4)A的核磁共振氢谱如图: | (4)综上所述,A的结构简式为________。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com