
【题目】一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高.其主要流程如下.请回答下列问题: 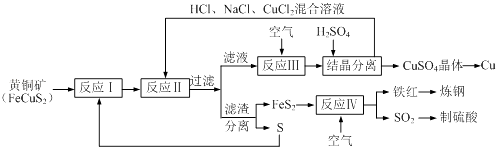
(1)反应Ⅲ的离子方程式为4CuCl2﹣+O2+4H+═4Cu2++8Cl﹣+2H2O,CuCl2﹣中铜元素的化合价为 , 该反应中的氧化剂是 .
(2)一定温度下,在反应Ⅲ所得的溶液中加入硫酸,可以析出硫酸铜晶体而不析出氯化铜晶体,其原因可能是 .
(3)炼钢时,可将铁红投入熔融的生铁中,以降低生铁的含碳量,该过程中主要反应的化学方程式是 .
(4)SO2尾气直接排放到大气中造成环境污染的后果是 .
(5)已知反应Ⅱ的离子方程式为Cu2++CuS+4Cl﹣═2CuCl2﹣+S,反应Ⅰ的产物为和 . (填化学式)
【答案】
(1)+1;O2
(2)该温度下,硫酸铜的溶解度小于氯化铜、加入硫酸,有利于析出硫酸铜晶体
(3)3C+Fe2O3 ![]() 2Fe+3CO↑
2Fe+3CO↑
(4)形成酸雨
(5)FeS2;CuS
【解析】解:铜矿与S在高温下煅烧,使其转变为FeS2、CuS,加入HCl、NaCl、CuCl2混合溶液 发生反应Cu2++CuS+4Cl﹣=2[CuCl2]﹣+S↓,过滤得到滤液中通入空气发生反应4CuCl2﹣+O2+4H+=4Cu2++8Cl﹣+2H2O,一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,结晶分离得到硫酸铜晶体,加入铁还原溶液得到铜;滤渣分离得到FeS和S,FeS2通入空气灼烧得到氧化铁和二氧化硫,氧化铁炼钢,二氧化硫制备硫酸,(1)CuCl2﹣中氯离子的化合价为﹣1价,2个氯离子为﹣2价,则铜元素的化合价为+1价;
反应4CuCl2﹣+O2+4H+═4Cu2++8Cl﹣+2H2O中,O2得到电子被还原,则O2为氧化剂,所以答案是:+1;O2;(2)相同条件下硫酸铜的溶解度小,则该温度下,硫酸铜的溶解度小于氯化铜,所以向反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,所以答案是:该温度下,硫酸铜的溶解度小于氯化铜、加入硫酸,有利于析出硫酸铜晶体;(3)炼钢时,可将铁红投入熔融的生铁中,滤液碳和氧化铁反应生成铁和一氧化碳,反应的化学方程式为:3C+Fe2O3 ![]() 2Fe+3CO↑,所以答案是:3C+Fe2O3
2Fe+3CO↑,所以答案是:3C+Fe2O3 ![]() 2Fe+3CO↑;(4)SO2尾气直接排放到大气中,二氧化硫溶于水形成亚硫酸,而亚硫酸容易被空气中氧气氧化成硫酸,导致雨水酸性增强,易形成酸雨,所以答案是:形成酸雨;(5)反应Ⅱ的离子方程式为Cu2++CuS+4Cl﹣═2CuCl2﹣+S,结合流程可知,黄铁矿分解生成的Fe、Cu均为+2价,则反应I的产物为:FeS2、CuS,所以答案是:FeS2;CuS.
2Fe+3CO↑;(4)SO2尾气直接排放到大气中,二氧化硫溶于水形成亚硫酸,而亚硫酸容易被空气中氧气氧化成硫酸,导致雨水酸性增强,易形成酸雨,所以答案是:形成酸雨;(5)反应Ⅱ的离子方程式为Cu2++CuS+4Cl﹣═2CuCl2﹣+S,结合流程可知,黄铁矿分解生成的Fe、Cu均为+2价,则反应I的产物为:FeS2、CuS,所以答案是:FeS2;CuS.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化 钾、氯化镁、硫酸铝和硫酸铁溶液,这种试剂是 ( )
A. NaOHB. NH3·H2OC. AgNO3D. BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的描述正确的是( )
A. 实验室配制CuCl2溶液时,需加入盐酸来抑制Cu2+水解
B. 定容时仰视容量瓶的刻度线,会导致所配溶液的浓度偏高
C. 用NaOH标准溶液滴定未知浓度的盐酸,未润洗锥形瓶会导致结果偏低
D. 称取2.0gNaOH固体时,先将天平调平,再将游码调至2.0g,向左盘加NaOH固体至天平平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+![]() O2(g)===CO2(g) ΔH=283.0 kJ·mol1
O2(g)===CO2(g) ΔH=283.0 kJ·mol1
②S(s)+O2(g)===SO2(g) ΔH=296.0 kJ·mol1
此反应的热化学方程式是___________________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)===NO(g)+CO2(g) ΔH=a kJ·mol1(a>0)
2CO(g)+2NO(g)===N2(g)+2CO2(g) ΔH=b kJ·mol1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为________mol,放出的热量为______________kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=574 kJ·mol1①
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①_______________________;②_______________________;③_______________________。
(2)溶液中共有_______种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L1的是____________,浓度为0.002 mol·L1的是____________。
(4)____________和____________两种粒子物质的量之和等于0.01 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色稀溶液X中,可能含有如表所列离子中的某几种。
阴离子 | CO |
阳离子 | Al3+、Fe3+、Mg2+、NH |
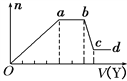
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
(1)若Y是盐酸,则溶液中含有的阳离子是______ ,ab段发生反应的总离子方程式为____________, Oa段上表中参加反应的离子的物质的量之比为________________________。
[要标明离子符号,如n(Fe3+)].
(2)若Y是NaOH溶液,则X中一定含有上表中的离子是________________________,它们的离子个数比为______________________________,[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列].ab段反应的离子方程式为______________________________, bc段反应的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的是( )
选项 | 实验目的 | 实验仪器或装置 |
A | 除去KCl中少的 MnO2 | 烧杯、玻璃棒、分液漏斗 |
B | 用10mol/L的盐酸配制100mL0.1mol/L的盐酸 | 100mL容量瓶、玻璃棒、烧杯 |
C | 用氯化钠溶液制备氯化钠晶体 |
|
D | 用右图装置验证SO2的漂白性 |
|
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com