
| A. | 平衡不会发生移动 | B. | SO3的质量分数增大 | ||
| C. | 混合气体的密度减小 | D. | 混合气体的平均相对分子质量不变 |
分析 A、若维持温度和容积不变,以3:3:2的物质的量之比再充入SO2、O2、SO3,则体系的压强增加,平衡正向移动;
B、体系的压强增加,平衡正向移动,SO3的质量分数增大;
C、混合气体的密度等于质量和体积的比值,根据质量和体积的变化来判断;
D、混合气体的平均相对分子质量等于质量和物质的量的比值,结合质量和物质的量的变化来判断.
解答 解:A、若维持温度和容积不变,以3:3:2的物质的量之比再充入SO2、O2、SO3,则体系的压强增加,平衡正向移动,故A错误;
B、若维持温度和容积不变,以3:3:2的物质的量之比再充入SO2、O2、SO3,则体系的压强增加,平衡正向移动,SO3的质量分数增大,故B正确;
C、混合气体的密度等于质量和体积的比值,质量是增加的,但是体积不变,所以密度增加,故C错误;
D、混合气体的平均相对分子质量等于质量和物质的量的比值,质量增加,平衡正向移动,物质的量减小,所以混合气体的平均相对分子质量增加,故D错误.
故选B.
点评 本题考查学生平衡移动的影响因素:压强,注意知识的迁移应用是关键,难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气有毒,所以不能用氯气对自来水进行消毒 | |
| B. | 液氯是纯净物,而氯水是混合物 | |
| C. | 碘化钾水溶液能使淀粉变蓝 | |
| D. | 在一个反应中,氧化剂和还原剂不可能是同一物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每消耗1molH2(g)释放483.6kJ的能量 | |
| B. | 每生成1molH2O(g)释放483.6kJ的能量 | |
| C. | 方程式中H2(g)计量数改变△H值不变 | |
| D. | 同条件下2molH2O(g)完全分解吸收的能量为483.6kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入冰醋酸Ka变小 | B. | 升高温度Ka变大 | ||
| C. | 通入HCl气体醋酸电离程度变小 | D. | 加入少量NaOH固体,Ka不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe3+、NO3-、SO42-、Na+ | |
| B. | 使酚酞变红色的溶液中:Na+、Al3+、HCO3-、NO3- | |
| C. | 能与金属铝反应生成氢气的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 无色透明的溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
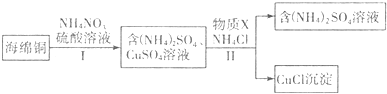
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
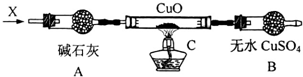 铜是常见的变价金属.为了比较正一价铜和正二价铜的稳定性,并研究氧化铜的氧化性,某化学小组的同学进行了以下实验.
铜是常见的变价金属.为了比较正一价铜和正二价铜的稳定性,并研究氧化铜的氧化性,某化学小组的同学进行了以下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
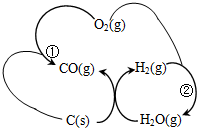 燃煤厂为减少SO2的排放,可采取的措施是:
燃煤厂为减少SO2的排放,可采取的措施是:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com