
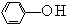
 )中羟基被硫羟基取代生成苯硫酚(
)中羟基被硫羟基取代生成苯硫酚(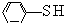 ),苯硫酚的酸性比苯酚的酸性强,原因是S-H键的键能比O-H键的弱,在水中更溶液电离出氢离子.
),苯硫酚的酸性比苯酚的酸性强,原因是S-H键的键能比O-H键的弱,在水中更溶液电离出氢离子.| 物质 | 熔点/℃ | 沸点/℃ | 水溶液 |
| 甲醇 | -97 | 64.7 | 互溶 |
| 甲硫醇 | -123 | 6.8 | 不溶 |

分析 (1)当基态原子的电子吸收能量后,电子会发生跃迁,激发态的S原子,其中1个3s电子跃迁到3p轨道,结合核外电子排布规律书写;
(2)S-H键的键能比O-H键的弱,在水中更溶液电离出氢离子;
(3)①分子中S原子形成2个σ键,含有2对孤对电子,S原子与连接原子之间为V形结构,C原子形成4个σ键,没有孤对电子,C原子、S原子的杂化轨道数目均为4;
②甲醇分子之间存在氢键,而甲硫醇分子之间为范德华力;
(4)铜离子与水分子之间形成配位键,水分子之间形成氢键、水分子与硫酸根离子之间也形成氢键;
(5)根据均摊法计算晶胞中各原子数目,进而计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)当基态原子的电子吸收能量后,电子会发生跃迁,激发态的S原子,其中1个3s电子跃迁到3p轨道,该激发态S原子的核外电子排布式为:1s22s22p63s13p5,
故答案为:跃迁;1s22s22p63s13p5;
(2)S-H键的键能比O-H键的弱,在水中更溶液电离出氢离子,苯硫酚的酸性比苯酚的酸性强,
故答案为:S-H键的键能比O-H键的弱,在水中更溶液电离出氢离子;
(3)①分子中S原子形成2个σ键,含有2对孤对电子,S原子与连接原子之间为V形结构,甲硫醇中C-S键与S-H键的键角小于(填“小于”或“等于”)180°,C原子形成4个σ键,没有孤对电子,C原子、S原子的杂化轨道数目均为4,均采取sp3杂化,
故答案为:小于;sp3;sp3;
②甲硫醇分子之间为范德华力,甲醇分子之间存在氢键,甲醇的熔沸点比甲硫醇的高,甲醇分子与水分子之间形成氢键,甲醇能与水互溶,
故答案为:甲醇分子之间存在氢键,甲醇的熔沸点比甲硫醇的高,甲醇能与水互溶是由于甲醇分子与水分子之间形成氢键,而甲硫醇中S的电负性小,不能形成氢键;
(4)铜离子与水分子之间形成配位键,水分子之间形成氢键、水分子与硫酸根离子之间也形成氢键,图中微粒中含有 4个配位键,4个氢键,
故答案为:4;4;
(5)晶胞中Cu原子数目为1+8×$\frac{1}{8}$+4×$\frac{1}{2}$=4,S原子数目为8,Fe原子数目为4×$\frac{1}{4}$+6×$\frac{1}{2}$=4,故晶胞的质量为$\frac{64×4+32×8+56×4}{6.02×1{0}^{23}}$g,该晶体的密度ρ=$\frac{64×4+32×8+56×4}{6.02×1{0}^{23}}$g÷(5×10-8cm×5×10-8cm×1.05×10-7cm)=4.66g•cm-3,
故答案为:4.66.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、分子结构与性质、杂化方式、氢键、配合物、晶胞计算等,是对物质结构主干知识的考查,(5)中计算为易错点,题目计算量大,关键是计算晶胞中原子数目.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的工作环境应在高温条件下 | |
| B. | 正极反应:O2+4H++4e-═2H2O | |
| C. | 电池工作时葡萄糖在负极上失去电子发生还原反应 | |
| D. | 电池工作时H+由负极移向正极,但电解液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子中所有原子都有可能处于同一平面上 | |
| B. | 都能在空气中燃烧,且燃烧时均伴有黑烟 | |
| C. | 都能被KMnO4酸性溶液氧化而使其褪色 | |
| D. | 都能与足量的溴水发生加成反应生成相同的四溴代烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .已知有机物X的键线式为
.已知有机物X的键线式为 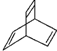 ,Y是X的同分异构体且属于芳香烃.下列关于Y的说法正确的是( )
,Y是X的同分异构体且属于芳香烃.下列关于Y的说法正确的是( )| A. | Y的结构简式为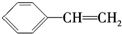 | |
| B. | Y能使溴水褪色,且反应后的混合液静置后不分层 | |
| C. | Y不能发生取代反应 | |
| D. | Y分子中的所有原子一定共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将乙酸和乙醇的混合液注入浓硫酸中制备乙酸乙酯 | |
| B. | 将铜丝在酒精灯外焰上加热变黑后再移至内焰,铜丝恢复原来的红色 | |
| C. | 在试管中注入2 mL CuSO4溶液,再滴几滴NaOH溶液后,加入乙醛溶液即有红色沉淀生成 | |
| D. | 向苯酚溶液中滴加几滴稀溴水出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上利用电解法冶炼铝和铁 | |
| B. | 生产和生活中常用可溶性铝盐和铜盐净水 | |
| C. | 工业合成氨的反应属于能自发进行的反应,故能迅速发生 | |
| D. | 热的纯碱溶液清洗带油污的餐具与盐类和酯类的水解均有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com