
常温下,pH=12的一元弱碱和pH=1的一元强酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法正确的是( )
A.反应后的溶液呈酸性
B.弱碱的浓度小于强酸的浓度
C.弱碱中OH-的浓度为0.1 mol·L-1
D.弱碱的浓度大于强酸的浓度
科目:高中化学 来源: 题型:
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析正确的是( )
A.CuS的溶解度大于PbS的溶解度
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-===CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列,)根据要求回答下列各小题:
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)在以上元素的基态原子的电子排布中 4s 轨道上只有 1 个电子的元素有________(填元素名称)。
(2)写出基态 Cr3+的电子排布式:________。
(3)Fe3+ 的化学性质比Fe2+稳定,其原因是________。
(4)试比较:第一电离能I1(Cr)________(填“>”“<”或“=”)I1(Co)。
(5)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )

A.2.5 μmol·L-1·min-1和2.0 μmol·L-1
B.2.5 μmol·L-1·min-1和2.5 μmol·L-1
C.3.0 μmol·L-1·min-1和3.0 μmol·L-1
D.5.0 μmol·L-1·min-1和3.0 μmol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知HF、CH3COOH均为弱酸,酸性强弱顺序为HF>CH3COOH,下列说法正确的是( )
A.浓度均为0.1 mol·L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强
B.0.1 mol·L-1 CH3COOH溶液,加水稀释过程中,所有离子浓度均减小
C.NaF溶液中只含有Na+、F-、H+、OH-、H2O五种微粒
D.NaF溶液中加入少量NaOH固体,溶液中c(F-)变小
查看答案和解析>>
科目:高中化学 来源: 题型:
对于重水D2O,在25℃时,KW=10-12,定义pD=-lgc(D+),则下列关于pD说法正确的是( )
A.25 ℃时,纯重水pD=7
B.25 ℃时,0.1 mol·L-1NaCl的重水溶液pD=pOD
C.25 ℃时,1 mol·L-1DCl的重水溶液pD=0,pOD=14
D.25 ℃时,0.1 mol·L-1NaOD的溶液中pD=10
查看答案和解析>>
科目:高中化学 来源: 题型:
现有常温下0.1 mol·L-1纯碱溶液。
(1)你认为该溶液呈碱性的原因是(用离子方程式表示)_____________________
___________________________________________________;
为证明你的上述观点,请设计一个简单的实验,简述实验过程:
________________________________________________________________________。
(2)同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO 不超过其总量的10%。请你设计实验证明该同学的观点是否正确:
不超过其总量的10%。请你设计实验证明该同学的观点是否正确:
________________________________________________________________________。
(3)同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是( )
A.c(Na+)=2c(CO )
)
B.c(CO )>c(OH-)>c(HCO
)>c(OH-)>c(HCO )>c(H2CO3)
)>c(H2CO3)
C.c(CO )+c(HCO
)+c(HCO )=0.1 mol·L-1
)=0.1 mol·L-1
D.c(OH-)=c(H+)+c(HCO )+2c(H2CO3)
)+2c(H2CO3)
(4)水解反应是典型的可逆反应。水解反应的化学平衡常数称为水解常数(用Kh表示),请写出Na2CO3第一步水解反应的水解常数的表示式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
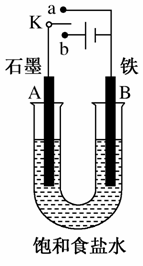
某课外活动小组用如图所示装置进行实验,请回答下列问题:
(1)若开始实验时开关K与a连接,则B极的电极反应式为________________________________________________________。
(2)若开始实验时开关K与b连接,则下列说法正确的是________(填序号)。
①溶液中Na+向A极移动
②从A极逸出的气体能使湿润的蓝色石蕊试纸先变红后褪色
③反应一段时间后向电解液中加适量盐酸可使其恢复到电解前的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列属于加成反应的是( )
A.C3H8+Cl2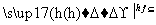 C3H7Cl+HCl
C3H7Cl+HCl
B.2CH3CHO+O2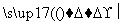 2CH3COOH
2CH3COOH
C.CH2===CH2+H2O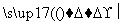 CH3CH2OH
CH3CH2OH
D.CH3CH2OH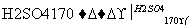 CH2===CH2↑+H2O
CH2===CH2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com