
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:实验题
| 装置 | 分别进行的实验 | 现象 |
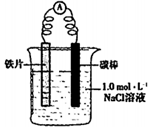 | i.连好装置 一段时间后,向烧杯中滴加酚酞 | 碳棒附近溶液变红 |
| ii.连好装置 一段时间后,向烧杯中滴加[K3[Fe(CN)6] | 铁片表面产生蓝色沉淀 |
| 实验 | 滴加 | 试管 | 现象 |
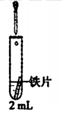 | 0.5mol.LK3[Fe(CN)6]溶液 | iii.蒸馏水 | 无明显变化 |
| iv.1.0mol•L-1NaCl溶液 | 铁片表面产生大量蓝色沉淀 | ||
| v.0.5mol•L-1Na2SO4溶液 | 无明显变化 |
| 实验 | 试剂 | 现象 |
| A | 酸洗后的铁片K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
| B | 酸洗后的铁片K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
| C | 铁片K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
| D | 铁片K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
| B | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中一定有SO42- |
| C | 向10mL 0.2mol/LNaOH溶液中先滴入2滴0.1mol/LMgCl2溶液,再滴加2滴0.1mol/LFeCl3溶液 | 先有白色沉淀生成,加入FeCl3溶液后,又有红褐色沉淀生成 | 在相同的温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| D | 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中一定无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6和C3H8不存在同分异构体,CH2O和C2H4O2互为同系物 | |
| B. | 一定条件下,乙烯、乙酸乙酯和淀粉都能与水反应 | |
| C. | 乙烯和苯分子中都含有碳碳双键,都能使溴水褪色 | |
| D. | 糖类、油脂和蛋白质都能发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素R、T、Q、W、G在元素周期表中的相对位置如下表所示,其中Q是无机非金属材料的主角.下列判断正确的是( )
短周期元素R、T、Q、W、G在元素周期表中的相对位置如下表所示,其中Q是无机非金属材料的主角.下列判断正确的是( )| A. | 离子半径:T<W<G | |
| B. | 等物质的量的W、G单质分别与足量铁粉反应,前者消耗的铁粉多 | |
| C. | 最简单气态氢化物的热稳定性:Q>R | |
| D. | 工业上通过电解T和G组成的化合物冶炼T的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某有机物的结构简式如图,它可能发生的反应类型有( )
某有机物的结构简式如图,它可能发生的反应类型有( )| A. | ①②③④⑥ | B. | ②③④⑤⑧ | C. | ③④⑤⑥⑦ | D. | ①②③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) | |
| B. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1mol AgCl和0.1molAgI混合后加入100mL水中,所得溶液中c(Cl-)=c(I-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com