
| A. | ①② | B. | ②④ | C. | ①④ | D. | ②③ |
分析 ①晶体中原子呈周期性有序排列而非晶体中原子排列无序,晶体有自范性,非晶体无自范性;
②含有金属阳离子的晶体不一定是离子晶体,可能是金属晶体;
③共价键可决定分子的稳定性;
④晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列,有自范性.
解答 解:①晶体中原子呈周期性有序排列而非晶体中原子排列无序,晶体有自范性,非晶体无自范性,可以利用X射线鉴别晶体和非晶体,故正确;
②金属晶体是由金属阳离子和自由电子构成的,所以含有金属阳离子的晶体不一定是离子晶体,可能是金属晶体,故错误;
③共价键可决定分子的稳定性,分子间作用力决定分子晶体熔沸点,故错误;
④晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列,有自范性,可以利用X射线鉴别晶体和非晶体,故正确;
故选D.
点评 本题考查晶体和非晶体区别及晶体构成微粒判断等知识点,明确晶体和非晶体特点、晶体构成微粒及晶体稳定性影响因素即可解答,注意分子间作用力和氢键影响分子晶体熔沸点、化学键影响其稳定性,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| B. | 用湿润的红色石蕊试纸检验氨气 | |
| C. | 在50 mL量筒中配制0.1mol•L-1碳酸钠溶液 | |
| D. | 金属钠着火时,用细沙覆盖灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、Fe2+、NO3-、Cl- | |
| B. | pH=7的溶液中:Fe3+、Mg2+、Cl-、SO42- | |
| C. | 使酚酞变红的溶液中:Ba2+、Cl-、Na+、NO3- | |
| D. | 加入铝粉产生氢气的溶液:Na+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
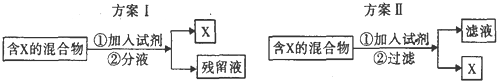
| A. | 若含X的混合物为碘水,可通过方案I进行分离,加入试剂为CC14液体,充分振荡后液体分层,上层为X的CC14溶液 | |
| B. | 若含X的混合物为乙醇和水,可通过方案Ⅱ进行分离,加入试剂为生石灰 | |
| C. | 若含X的混和物为KNO3和NaCl,可通过方案II进行分离,加入试剂为适量沸水 | |
| D. | 若含X的混合物为皂化反应后的混合物,可通过方案I进行分离,加入试剂为饱和食盐水,残留液中含有甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
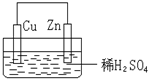
| A. | 铜片为负极 | B. | 锌片为负极 | ||
| C. | 电子通过导线由铜片流向锌片 | D. | 铜片上没有有H2逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
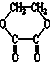 ⑤
⑤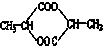 ⑥
⑥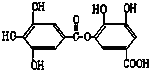 ⑦
⑦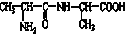 ,符合题意的物质可能是( )
,符合题意的物质可能是( )| A. | ①②⑤⑦ | B. | ②④⑤⑦ | C. | ②⑤⑥⑦ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 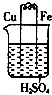 铁上有气泡 铁上有气泡 | |
| B. |  铜上有气泡 铜上有气泡 | |
| C. |  铁片上析出红色的铜 铁片上析出红色的铜 | |
| D. |  AB为导体,反应一段时间后,铁球向下倾斜 AB为导体,反应一段时间后,铁球向下倾斜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
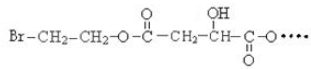
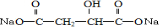 BHOCH2CH2OHC
BHOCH2CH2OHC D
D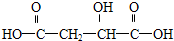
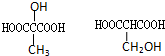
 .
.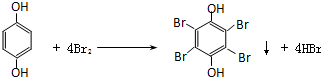 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com