
| A. | O2 | B. | Fe(OH)2 | C. | Fe | D. | Fe(OH)3 |
科目:高中化学 来源: 题型:填空题
 Ⅰ有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:
Ⅰ有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题: .将N2H4和O2通入到由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为N2H4-4e-+4OH-=N2↑+4H2O.
.将N2H4和O2通入到由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为N2H4-4e-+4OH-=N2↑+4H2O.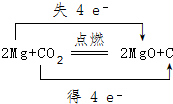 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 | |
| B. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 | |
| C. | 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 | |
| D. | 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
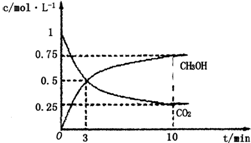 在lL的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
在lL的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气、氯水、液氯是同一种物质,只是状态不同 | |
| B. | 氯水和液氯都可以使干燥的布条褪色 | |
| C. | 用氯气消毒过的自来水配制硝酸银溶液时,药品不会变质 | |
| D. | 氯水溶液呈浅绿色,且有刺激性气味,说明氯水中有Cl2存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═CO2↑+H2ON BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-═CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-═H2O Ba(OH)2+H2SO4═BaSO4↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com