
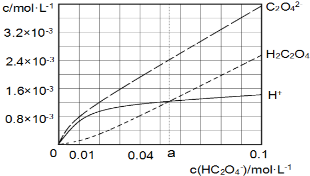
 25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )
25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )| A. | 当c(HC2O4ˉ)=0.1mol•Lˉ1时,c(H+)>c(C2O42-)-c(H2C2O4) | |
| B. | 当c(HC2O4ˉ)>amol•Lˉ1时,c(H+)<c(H2C2O4),HC2O4ˉ的水解程度大于电离程度 | |
| C. | HC2O4ˉ?C2O42-+H+,Ka(HC2O4ˉ)=a | |
| D. | 将0.08mol•Lˉ1H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4ˉ)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OHˉ) |
分析 A.根据草酸氢钠溶液中的电荷守恒、物料守恒判断;
B.根据图象可知,c(HC2O4ˉ)>amol•L-1时,c(C2O42-)>c(H2C2O4),说明草酸氢根离子的电离程度大于其水解程度;
C.根据图象可知Ka(HC2O4ˉ)=a时,氢离子与醋酸的浓度相等,然后结合草酸氢根离子的电离平衡常数的表达式计算;
D.反应后溶质为0.04mol/L的NaHC2O4溶液,根据图象可知c(C2O42-)>c(H+)>c(H2C2O4).
解答 解:A.根据NaHC2O4溶液中的物料守恒得c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42- ),根据电荷守恒可得:c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42- )+c(OH-),二者结合可得:c(H2C2O4)+c(H+)=c(C2O42- )+c(OH-),则c(H+)=c(C2O42-)+c(OH-)-c(H2C2O4),所以c(H+)>c(C2O42-)-c(H2C2O4),故A正确;
B.当c(HC2O4ˉ)>amol•L-1时,c(H+)<c(H2C2O4),根据图象可知,c(HC2O4ˉ)>amol•L-1时,c(C2O42-)>c(H2C2O4),则HC2O4ˉ的水解程度小于电离程度,故B错误;
C.Ka(HC2O4ˉ)=a时c(H+)=c(H2C2O4),由于草酸氢根的电离程度较小,则c(HC2O4ˉ)≈amol•L-1,Ka(HC2O4ˉ)=$\frac{c({C}_{2}{{O}_{4}}^{2-})•c({H}^{+})}{c(H{C}_{2}{{O}_{4}}^{-})}$=$\frac{1.2×1{0}^{-3}×2.4×1{0}^{-3}}{a}$,草酸的电离平衡常数为:$\frac{c(H{C}_{2}{{O}_{4}}^{-})•c({H}^{+})}{c({H}_{2}{C}_{2}C{O}_{4})}$=c(HC2O4ˉ)≈a,草酸的第二步电离小于第一步电离,则Ka(HC2O4ˉ)<a,故C错误;
D.将0.08mol•Lˉ1H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),反应后溶质为0.04mol/L的NaHC2O4溶液,根据图象可知c(C2O42-)>c(H+)>c(H2C2O4),正确的离子浓度大小为:c(Na+)>c(HC2O4ˉ)>c(C2O42-)>c(H+)>c(H2C2O4)>c(OH-),故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
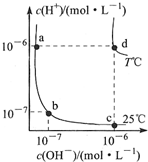
| A. | d点对应的食盐水pH=6,呈中性 | |
| B. | 向a点对应的醋酸溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-) | |
| C. | T℃时,0.05mol/LBa(OH)2溶液的pH=11 | |
| D. | a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ.mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
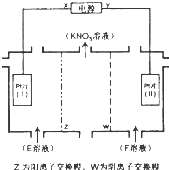
| A. | X为负极,F溶液NaNO3溶液 | |
| B. | 电解一段时间,往Pt片(I)附近滴入酚酞,溶液变红 | |
| C. | 电解总反应方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| D. | 理论上,当得到0.1molKNO3时,Pt片(Ⅱ)上生成标准状况下为1.12L的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
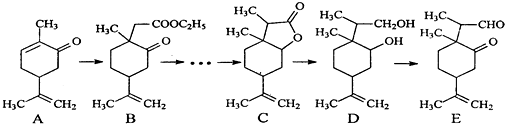
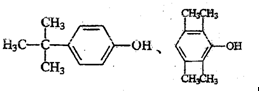 .
.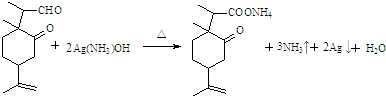 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | 进行焰色反应,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%-5%的小苏打溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
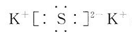 ,A属于离子化合物.
,A属于离子化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com