
【题目】以下变化中需要加入还原剂才能实现的是( )
A. Cl-→Cl2 B. SO42-→BaSO4 C. Cu→Cu2+ D. MnO4-→Mn2+
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的可逆反应:X(s)+3Y(g)2Z(g)(△H<0).为了使平衡向生成Z的方向移动,应选择的条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z.
A.①③⑤
B.②③⑤
C.②③⑥
D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于Ⅲ区域的是( )

A. Cl2+2KBr=Br2+2KCl B. 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C. 2Na2O2+2CO2=2Na2CO3+O2 D. 4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N﹣CH2﹣COONa)即可得到配合物A.其结构如图1:
(1)Cu元素基态原子的外围电子排布式为 .
(2)元索C、N、O的第一电离能由大到小排列顺序为 .
(3)配合物A中碳原子的轨道杂化类型为 .
(4)1mol氨基乙酸钠(H2N﹣CH2﹣COONa)含有σ键的数目为 .
(5)氨基乙酸钠分解产物之一为二氧化碳.写出二氧化碳的一种等电子体:(写化学式).
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图2,则该化合物的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(X)与溶液中沉淀物的量(Y)的关系示意图中正确的是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不可用于设计原电池的是( )
A.NaOH+HCl═NaCl+H2O
B.2CH3OH+3O2→2CO2+4H2O
C.Zn+2HCl═ZnCl2+H2↑
D.4Al+3O2+6H2O═4Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-,可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量氢氧化钠溶液;③加适量盐酸;④加过量碳酸钠溶液;⑤加过量氯化钡溶液。下列操作顺序正确的是
A.⑤②④①③B.④①②⑤③
C.④②⑤①③D.①④②⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰( MnO2)和石英(SiO2)。为了制取Cl2和探究氯及其化合物的相关性质,进行如下实验。
【查阅资料】MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
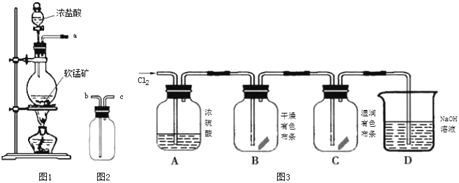
【制取气体】
(1)取适量矿样置于烧瓶中,加入足量浓盐酸并加热,充分反应后烧瓶中残留的固体是____。
(2)收集氯气应将图1导管的a接口与图2导管的_____________接口连接(填“b”或“c)。
(3)已知氯气中含有HCl杂质,可用______________除去。
【实验探究】
(4)把红热的铁丝伸入盛有氯气的集气瓶中,铁丝燃烧产生棕褐色的烟。反应的化学方程式是_______________________________________________________________________。
(5)按图3进行实验,观察到B中的有色布条不褪色,C中的有色布条褪色。由此得出的结论是_____________________________________________________________________。
(6)写出C中反应的化学方程式:_________________________________________________。
【联系实际】
(7)某氯碱工厂的氯气管道发生泄漏,以下采取的措施正确的是______________ (双项选择,填序号)。
A.将人群向高处疏散
B.将人群向低处疏散
C.关闭氯气管道,用碱液浸泡过的棉布覆盖泄漏部位
D.关闭氯气管道,用饱和NaCl溶液浸泡过的棉布覆盖泄漏部位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH﹣ , CO32﹣ , AlO2﹣ , SiO32﹣ , SO42﹣ , K+ , Na+ , Fe3+ , Mg2+ , Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )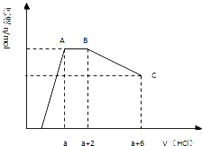
A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32﹣与AlO2﹣的物质的量比为3:4
D.原溶液中一定含有的离子是OH﹣ , CO32﹣ , SiO32﹣ , AlO2﹣ , K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com