

| 假 设 | 操 作 | 现 象 | 原 理 |
| Na2S2O4为强碱弱酸盐,其溶液为碱性. | 取少量溶液于试管中,滴加 ②紫色石蕊试液 | 溶液变成蓝色 | S2O42-水解,使溶液成碱性 |
| ①Na2S2O4具有还原性 | 取少量溶液于试管中,滴加过量新制氯水,再滴加 BaCl2 溶液 | 有白色沉淀生成 | 该反应的离子方程式依次为:③4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+,④Ba2++SO42-=BaSO4↓ |
分析 A 中反应即铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,据此书写;连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇,因此可以用乙醇洗涤产品.因为吸收过程中 D中颜色逐渐褪去,说明二氧化硫吸收效率低,应减慢生成二氧化硫的速率,所以此时应该采取的措施是撤去A中酒精灯,减缓SO2的生成速率.
(1)A 中盛装浓硫酸的仪器,可根据仪器结构分析;
(2)A 中反应即铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,据此书写;连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇,因此可以用乙醇洗涤产品;
(3)根据吸收过程中 D中颜色逐渐褪去,说明二氧化硫吸收效率低,应减慢生成二氧化硫的速率;
II.【Na2S2O4 的性质】根据碱遇紫色石蕊试液变成蓝色,滴加过量新制氯水,再滴加 BaCl2溶液有白色沉淀生成,说明生成硫酸根,据此分析;
III.【测定 Na2S2O4的纯度】根据4HCl+2Na2S2O4=4NaCl+S↓+3SO2↑+2H2O,所以取 8.00g 制备的晶体溶解后,加入足量稀硫酸,充分反应后,过滤、洗涤、干燥得固 体 0.64g即为S单质质量,据此计算.
解答 解:(1)A 中盛装浓硫酸的仪器是分液漏斗,
故答案为:分液漏斗;
(2)A 中反应即铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,则化学方程式为:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
连二亚硫酸钠易溶于水,难溶于乙醇,因此可以用乙醇洗涤产品,减少因溶解导致的损失,
故答案为:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;乙醇;
(3)因为吸收过程中 D中颜色逐渐褪去,说明二氧化硫吸收效率低,应减慢生成二氧化硫的速率,所以此时应该采取的措施是撤去A中酒精灯,减缓SO2的生成速率;故答案为:撤去A中酒精灯,减缓SO2的生成速率;
II.【Na2S2O4 的性质】因为碱遇紫色石蕊试液变成蓝色,所以取少量溶液于试管中,应滴加紫色石蕊试液;因为滴加过量新制氯水,再滴加 BaCl2溶液有白色沉淀生成,说明新制氯水将Na2S2O4 中 S 氧化生成硫酸根,硫酸根再与钡离子反应生成白色硫酸钡沉淀,离子方程式为:4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+
,Ba2++SO42-=BaSO4↓;
故答案为:
| 假设 | 操作 | 现象 | 原理 |
| 紫色石蕊试液 | |||
| Na2S2O4具有还原性 | 4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+ Ba2++SO42-=BaSO4↓ |
点评 本题考查物质制备和检验、实验设计与探究等,是对学生综合能力的考查,为高考常考题型,注意对题目信息的应用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Na2O2与 H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 氯气与水反应:Cl2+H2O═Cl-+2H++ClO- | |
| D. | 碳酸镁与稀盐酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
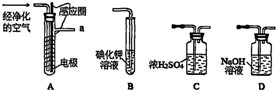
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
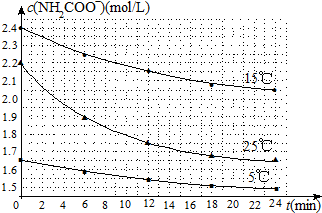
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
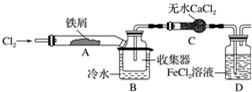 FeCl3在现代工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
FeCl3在现代工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com