
| A. | 气态氢化物的稳定性:D>C | B. | 四种元素一定属于短周期元素 | ||
| C. | 单质的还原性:B>A | D. | 原子序数:b>a>c>d |
分析 由aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,结合元素周期律递变规律解答该题.
解答 解:已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,则
A.C、D在同一周期,且原子序数C>D,非金属性:C>D,元素的非金属性越强,对应的氢化物越稳定,则气态氢化物的稳定性:C>D,故A错误;
B.A、B可能为第四周期元素,如K、Ca,故B错误;
C.A、B在周期表中同周期,原子序数:b>a,金属性:A>B,单质的还原性:A>B,故C错误;
D.由以上分析可知原子序数:b>a>c>d,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
在下列各组的比较中,前者比后者大的是
A.同温度、同浓度的NaCl溶液和氨水的导电能力
B.25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度
C.25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度
D.25℃时,pH均为3的盐酸和FeCl3溶液中水的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是内层电子数的三倍 |
| C | 在第三周期中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.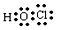 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小 | |
| B. | 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu | |
| C. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H>0,△S<0 | |
| D. | 将如图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深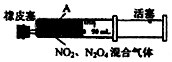 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
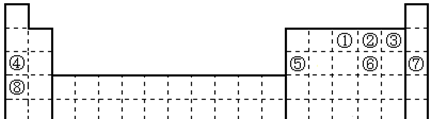
 ;写出②含有10个中子的核素的化学符号${\;}_{8}^{18}$O.
;写出②含有10个中子的核素的化学符号${\;}_{8}^{18}$O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤化氢中,以HF沸点最高,是由于HF分子间存在氢键 | |
| B. | 邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低 | |
| C. | H2O的沸点比HF的沸点高,是由于水中氢键键能大 | |
| D. | 氨气极易溶于水与氨气分子和水分子形成氢键有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
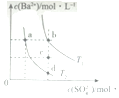
| A. | T1时,c点有沉淀生成 | |
| B. | T2时,蒸发溶剂可能由d点变到b点 | |
| C. | T2时,由a点开始加入BaCl2固体,Ksp增大 | |
| D. | BaSO4的溶解度随温度升高而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | △H1>△H2 | |
| B. | 设计反应①的主要目的是增大n(CO)/n(H2)的比值 | |
| C. | CO(g)+H2O(g)?CO2(g)+H2(g)的正反应为吸热反应 | |
| D. | △H2=4△H1=659.3 KJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com