
一定条件下1molN2和4mol H2通入到V升的容器中发生反应,反应前容器中的压强为P,保持温度和体积不变,10min后反应达到平衡,此时容器内混合气体平均相对分子质量为9,试求
(1)平衡时,体系内压强为多少?
(2)平衡时,氨气的体积分数为多少?
29.(1) 0.8P (2) 25%
【解析】
试题分析:(1)一定条件下1molN2和4mol H2通入到V升的容器中发生反应,反应前容器中的压强为P,10min后反应达到平衡,设氮气消耗物质的量为x
N2+ 3H2 = 2NH3
起始量(mol)1 4 0
变化量(mol)x 3x 2x
平衡量(mol)1-x 4-3x 2x容器内混合气体平均相对分子质量为9,反应前后气体质量守恒,则M=(1x28+4x2)/(5-2x) =9 计算得到x=0.5 所以平衡时压强之比等于物质的量之比,P:P平=5:(5-2×0,5)=5:4 平衡时体系内压强为0.8P,答:平衡时,体系内压强为0.8P;
(2)平衡时,氨气的体积分数=2x/(5-2x)×100%=1/4×100%=25%,
答:平衡时,氨气的体积分数为25%.
考点:考查依据化学平衡三段式列式计算平衡物质的量等相关计算。


科目:高中化学 来源:2015届湖北省高一上学期期中考试化学试卷(解析版) 题型:选择题
丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1 g/mL,沸点约55 oC,分离水和丙酮时最合理的方法是
A.升华 B.蒸馏 C.过滤 D.分液
查看答案和解析>>
科目:高中化学 来源:2015届湖北省四校高三上学期期中联考化学试卷(解析版) 题型:选择题
设NA代表阿佛加德罗常数,下列说法中正确的是:( )
①常温常压下,1mol氦气含有的核外电子数为4NA
②常温常压下,17g甲基(—14CH3)所含的中子数为8NA
③64g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL 0.5mol/L 的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标准状况下,22.4 L C2H5OH中含有的氢原子数为6 NA
⑥常温常压22.4L NO气体的分子数小于NA
A.①②⑤ B.③④⑤ C.②④⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届湖北省咸宁市高三三校联考化学试卷(解析版) 题型:选择题
化学中有许多物质之间的反应符合下列关系图,图中其他产物及反应所需条件均已略去。
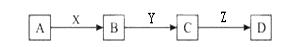
下列说法正确的是
A.若X、Y为Fe,Z是氢氧化钠则D可能为氢氧化铁
B.若X为NaOH,Y、Z为氧气,则D一定为酸性氧化物
C.若X、Y为O2,Z为水则D一定为H2SO4
D.若X、Y、Z全为O2符合条件的A不止一种
查看答案和解析>>
科目:高中化学 来源:2015届湖北省咸宁市高三三校联考化学试卷(解析版) 题型:选择题
下列有关氧化还原反应说法正确的是
A.工业制硫酸、工业制硝酸、由石英获取单晶硅全程变化均为氧化还原反应
B.氧化反应与还原反应一定同时发生,但氧化剂、还原剂可不直接接触
C.置换反应肯定都是氧化还原反应,但复分解反应可能是氧化还原反应
D.氧化还原反应中氧化产物与还原产物不会再发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:实验题
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。
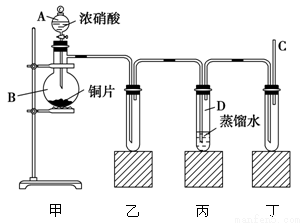
请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是________,该装置中发生反应的化学方程式为________________。
(2)实验过程中,装置乙、丙中出现的现象分别是________________;________________;装置丙中的试管内发生反应的离子方程式为________________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是______。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为________色。
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:选择题
将 0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是
A.M B.M2+ C.M3+ D.MO2+
查看答案和解析>>
科目:高中化学 来源:2015届浙江省协作体高三第一次适应性测试理科综合化学卷(解析版) 题型:填空题
(16分)有机物I是制备液晶材料的重要中间体,其合成途径如下:
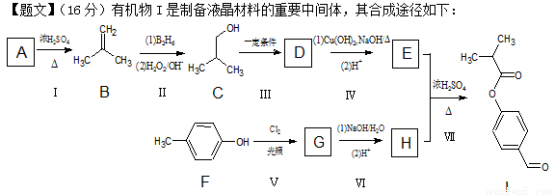
已知:一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的核磁共振氢谱有2种峰,则A的结构简式为 。
(2)C的系统命名法为 。
(3)反应Ⅳ在(1)条件下的离子方程式为 。
(4)反应Ⅰ→Ⅴ中属于氧化反应的有 。
(5)根据反应Ⅱ的信息完成以下反应方程式:
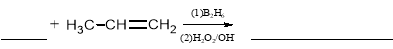 。
。
(6)为反应Ⅲ设计所需试剂与条件是: 。
(7)已知X为E的同分异构体,X与硬酯酸甘油脂具有相同的官能团,还能发生银镜反应。写出所有满足条件的X的结构简式: 。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高三第一次联考化学试卷(解析版) 题型:填空题
(12分).铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为 ,
PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得反应的离子方程式为 ;
PbO2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为_ _。若电解液中不加入Cu(NO3)2,主要缺点是 。
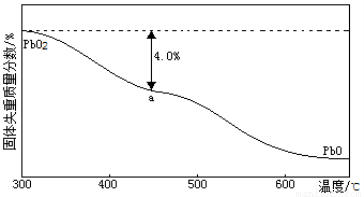
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%( )的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_ 。
)的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com