
分析 甲烷的物质的量为$\frac{8g}{16g/mol}$=0.5mol,即0.5mol甲烷完全燃烧,当恢复至原状态时,放出445kJ热量,可知1mol甲烷完全燃烧,当恢复至原状态时,放出445kJ×2=990kJ热量,结合物质的状态书写热化学方程式,以此来解答.
解答 解:甲烷的物质的量为$\frac{8g}{16g/mol}$=0.5mol,即0.5mol甲烷完全燃烧生成液态水时放出445kJ热量,1mol甲烷反应燃烧反应放热445kJ×2=890kJ,则反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol.
点评 本题考查热化学反应方程式的书写,为高频考点,把握物质的量与热量的关系、物质的状态及热化学反应方程式的书写为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:实验题
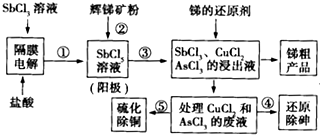 我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图.
我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组设计的一种提取锑的工艺流程如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20ml某浓度的硫酸溶液中滴入0.1mol•l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20ml某浓度的硫酸溶液中滴入0.1mol•l-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )| A. | V=40 | |
| B. | C点所示溶液中:c(H+)-c(OH-)═2c(NH3•H2O) | |
| C. | d点所示溶液中:c(NH4+)═2c(SO42-) | |
| D. | NH3•H2O的电离常数K=10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
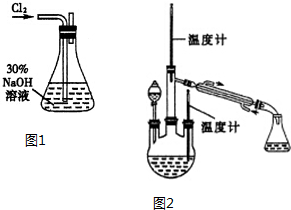 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H20).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H20).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:H2O>H2S>SiH4 | |
| B. | 离子半径:Cl->O2->Mg2+ | |
| C. | 物质酸性:H3PO4>H2SO4>HClO4 | |
| D. | 熔点:KCl>K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
| A. | 放出248 kJ 热量 | B. | 吸收248 kJ 热量 | C. | 放出183kJ 热量 | D. | 吸收183 kJ 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(NO3)2的物质的量为0.01mol | B. | 通入Cl2的体积(标准状况)为448mL | ||
| C. | 放出H2的体积(标准状况)为112mL | D. | 得到不溶固体的质量为6.72g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com