

| n |
| V |
| 58.5g |
| 96% |
| n |
| V |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | HI | H2 | I2 |
| 浓度/(mol?L-1) | 0.40 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
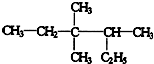
 ,
,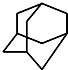 .的分子式为
.的分子式为查看答案和解析>>
科目:高中化学 来源: 题型:

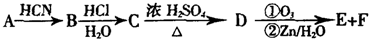
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称量时,将NaOH固体直接放在天平托盘上面的纸上 |
| B、将称好的NaOH固体直接放入容量瓶中,加入少量水溶解 |
| C、在烧杯中溶解NaOH固体后,立即将所得溶液注入容量瓶中 |
| D、将烧杯中已冷却的NaOH溶液注入容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、地下钢管连接镁块 |
| B、金属护拦表面涂漆 |
| C、枪炮表面涂上一层油 |
| D、水中的钢闸门连接电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、② | B、②③④ | C、只有④ | D、① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com