
【题目】我国市售加碘食盐中含有碘酸钾。已知碘酸钾在酸性条件下是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
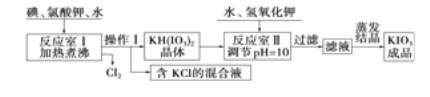
请回答下列问题:
(1)已知反应室Ⅰ发生的反应中,两种还原产物所得电子数相同,请写出该反应的化学方程式: 。
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:② (请从化学平衡角度解释)。
(3)已知几种物质的溶解度见下表:
KCl | KH(IO3)2 | KClO3 | |
溶解度g/100 g水(25 ℃) | 20.8 | 0.8 | 7.5 |
溶解度g/100 g水(80 ℃) | 37.1 | 12.4 | 16.2 |
由上表数据分析可知,操作Ⅰ的名称为 、 。
(4)在反应室Ⅱ中加入KOH调节溶液的pH=10,其目的是 。
(5)甲同学欲测定成品中碘酸钾的含量,设计了如下实验:
①准确称取1 g样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化上述所得溶液,加入过量KI溶液,充分搅拌;
③以淀粉为指示剂,逐滴加入2.0 mol·L-1的Na2S2O3溶液,当蓝色刚好褪去时,消耗Na2S2O3溶液12.00 mL,则成品中KIO3的质量分数为 (列式计算,结果保留三位有效数字)
(已知:KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O,I2+2Na2S2O3===2NaI+Na2S4O6)。
(6)乙同学又对纯净的NaCl(不含KIO3)进行了下列实验:
操作步骤 | 实验现象 |
取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 | 溶液无变化 |
然后再滴入1滴1mol/L的H2SO4,振荡。 | 溶液变蓝色 |
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
②根据乙同学的实验结果推测,甲同学的实验结果会 (填“偏大”,“偏小”或“无影响”)。
【答案】
(1)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(2)除去反应生成的氯气,有利于反应向正方向进行;
(3)冷却结晶,过滤;
(4)使KH(IO3)2转化为KIO3;
(5)85.6%;
(6)①4I-+4H++O2=2I2+2H2O;②偏大。
【解析】
试题分析:(1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低共60价,故I2系数为6,根据氯元素守恒可知KClO3系数为11,根据碘元素守恒可知KH(IO3)2的系数为6,根据氢元素守恒可知H2O、系数为3,检查氧元素守恒,故方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:②除去反应生成的氯气,有利于反应向正方向进行,故答案为:除去反应生成的氯气,有利于反应向正方向进行;
(3)从溶液中得到晶体,需要冷却结晶,然后过滤,故答案为:冷却结晶,过滤;
(4)KH(IO3)2在碱性条件下可以转化成KHIO3,所以步骤②中调节pH=10的目的是使KH(IO3)2转化为KIO3,故答案为:使KH(IO3)2转化为KIO3;
(5)设碘酸钾的物质的量为x.KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O①;
I2+2S2O3 2-=2I-+S4 O62-②,将方程式②×3+①得
IO3-+6H++6S2O32-=I-+3S4O62-+3H2O
1 6
x 2.0×10-3mol/L×0.012L
x=![]() =4×106mol,根据碘原子守恒知,
=4×106mol,根据碘原子守恒知,
碘酸钾的质量=4×106mol×214g/mol=856×10-6g,
所以碘元素的质量分数=![]() ×100%=85.6%,故答案为:85.6%;
×100%=85.6%,故答案为:85.6%;
(6)①酸性条件下,碘离子被氧气氧化生成碘单质,离子反应方程式为:4I-+4H++O2=2I2+2H2O,故答案为:4I-+4H++O2=2I2+2H2O;②酸性条件下,过量的碘离子易被空气中氧气氧化生成碘单质,导致测定结果偏大,故答案为:偏大。


科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学方程式为___ ___。利用反应6NO2+8NH3=7N2+12H2O也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______L。
(2)已知:2SO2(g)+O2(g) ![]() 2SO3(g) △H= -196.6kJ/mol
2SO3(g) △H= -196.6kJ/mol
2NO(g)+O2(g) ![]() 2NO2(g) △H= -113.0kJ/mol
2NO2(g) △H= -113.0kJ/mol
则反应NO2(g)+SO2(g) =SO3(g)+NO(g)的△H=______kJ/mol。
(3)如下图所示,相同体积的a、b、c三密闭容器,其中c容器有一活塞,a、b两容器为定容容器,起始向三容器中都加入相同量的SO2和O2使三容器压强相等,一定条件下发生2SO2(g)+O2(g) ![]() 2SO3(g)的反应。问:
2SO3(g)的反应。问:
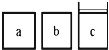
①起始a、c两容器的反应速率大小关系为Va_____Vc;(填“>”“<”或“=”下同)
②反应一段时间后a、c中速率大小关系为Va_____Vc;
③如起始在a、c两容器中通入等量的He,则此时三容器起始压强为Pa_____Pb_____Pc;起始反应速率关系为Va_____Vb_____Vc。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)某温度下,若把1 mol N2与3 mol H2置于体积为1L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为1/3,则该温度下反应的K的计算式=________(用分数表示)。能说明该反应达到化学平衡状态的是________(填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。

(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。请根据装置回答下列问题:

(1)将铝片加入小试管内,然后注入足量的盐酸,有关反应的离子方程式是_____________________,试管中看到的现象是_______________________。
(2)弯管中A端液面________(填“上升”或“下降”),原因是_________________;说明此反应是________(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究铁发生电化学腐蚀的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化(结果如图2)。下列叙述错误的是

A.图2中,t2时容器中压强明显小于起始压强是因为铁粉发生了吸氧腐蚀
B.碳粉表面的电极反应式只有:2H2O + O2 + 4e-== 4OH-
C.碳粉表面一定发生了还原反应
D.图3中,发生腐蚀时电子转移方向如箭头所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法不符合事实的是
A.SO2可用于杀菌、消毒 B.HF可用于雕刻玻璃
C.NH3可用于制硝酸 D.SiO2可用于制太阳能电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于晶体的下列说法正确的是( )
A. 只要含有金属阳离子的晶体就一定是离子晶体
B. 离子晶体中一定含金属阳离子
C. 在共价化合物分子中各原子都形成8电子结构
D. 分子晶体的熔点不一定比金属晶体熔点低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com