
| A. | 保持其他条件不变,升高温度,H2S浓度增加,表明该反应是吸热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为7 mol | |
| D. | CO的平衡转化率为80% |
分析 反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,设反应前H2S物质的量为n,则:
CO(g)+H2S(g)?COS(g)+H2(g)
起始(mol):10 n 0 0
变化(mol):2 2 2 2
平衡(mol):8 n-2 2 2
结合平衡常数可计算n值,并以此计算其它量,以此解答该题.
解答 解:A.升高温度,H2S浓度增大,说明平衡向逆反应方向移动,逆反应吸热,正反应放热,故A错误;
B.通入CO气体瞬间正反应速率增大,达到最大值,向正反应方向建立新的平衡,正反应速率开始减小,故B错误;
C.设反应前H2S的物质的量为n mol,容器的容积为1 L,则
CO(g)+H2S(g)?COS(g)+H2(g)
起始(mol):10 n 0 0
变化(mol):2 2 2 2
平衡(mol):8 n-2 2 2
因为该反应是反应前后气体体积不变的反应,所以有K=$\frac{2×2}{8×(n-2)}$=0.1,解得n=7,故C正确;
D.CO的转化率为$\frac{2}{10}×100%$=20%,故D错误.
故选C.
点评 本题考查化学平衡的计算,题目难度中等,涉及影响化学反应速率的因素、化学平衡常数应用、化学平衡的有关计算,注意理解掌握三段式均解题法在化学平衡计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
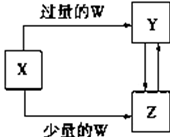 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )| 选项 | W | X |
| A | 稀硫酸 | NaAlO2溶液 |
| B | 稀硝酸 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | Cl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.7 mol/(L.min) | B. | v(B)=0.3mol/(L.min) | ||
| C. | v(C)=0.9 mol/(L.min) | D. | v(D)=1.1mol/(L.min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OHˉ)+c(Aˉ) | |
| B. | HA为弱酸 | |
| C. | 常温下,MA溶液的pH>7 | |
| D. | N点水的电离程度小于K点水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com