
【化学—选修3:物质结构与性质】第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个 键和1个大
键和1个大 键,C6H6是非极性分子
键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
元 素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
Mn原子价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)根据元素原子的外围电子排布,可将元素周期表分区,其中Ti属于____________区。Ti的一种氧化物X,其晶胞结构如上图所示,则X的 化学式为 。

(4)某铁的化合物结构简式如右图所示
①组成上述化合物中各非金属元素电负性由大到小的顺序为
(用元素符号表示)
②在右图中用“→”标出亚铁离子的配位键。

(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为 ,这几个O2-构成的空间构型为 。已知Ni2+与O2-的核间距为anm, NiO的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则该晶体的密度为________ g/cm3。
科目:高中化学 来源:2015-2016学年山东省临沂市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列对能量转化的认识中,不正确的是( )
A.电解水生成氢气和氧气时,电能主要转化为化学能
B.风力发电时,风能主要转化为电能
C.白炽灯工作时,电能全部转化为光能
D.煤燃烧时,化学能主要转化为热能
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川一中高三三模理综化学试卷(解析版) 题型:选择题
苹果酸(HOOCCHOHCH2COOH)是重要的食品添加剂,有多种同分异构体,其中与苹果酸的官能团相同,官能团的个数也相同的有(不考虑立体异构)
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三全真模拟理综化学试卷(解析版) 题型:填空题
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等。钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
又已知:①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③KSP(BaSO4)=1.1×10-10,KSP(BaCO3)=5.1×10-9。
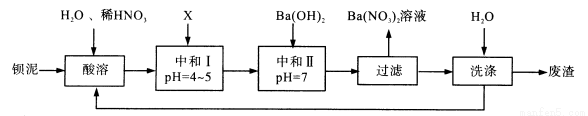
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。试用离子方程式说明提纯原理:
。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为: 。
(3)该厂结合本厂实际,选用的X为 (填序号);
A.BaCl2 B.BaCO3 C.Ba(NO3)2 D.Ba(OH)2
(4)中和I使溶液的p H为4~5目的是 ;结合离子方程式简述原理 。
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是 。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取W克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三全真模拟理综化学试卷(解析版) 题型:选择题
叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是( )
A、HN3与NH3作用生成的叠氮酸铵是共价化合物
B、HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3?)>c(OH?)
C、NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3?) >c(OH?)>c(H+)
D、N3?与CO2含相等电子数
查看答案和解析>>
科目:高中化学 来源:2016届湖北省沙市、沙市五中高考模拟理综化学试卷(解析版) 题型:选择题
常温下,浓度均为0.10 mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随 的变化如图所示,下列叙述正确的是
的变化如图所示,下列叙述正确的是

A.该温度下HB的电离平衡常数a < b
B.溶液中水的电离程度:a=c>b
C.相同条件下NaA溶液的pH小于NaB溶液的pH
D.当 时,若同时微热两种溶液(不考虑HA、HB和H2O的挥发),则
时,若同时微热两种溶液(不考虑HA、HB和H2O的挥发),则 减小
减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:计算题
把3molA和2.5molB混合与2L密闭容器中,发生反应:3A(g)+B(g) xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
(1)x= 。
(2)平衡时C的浓度为多少?(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
原电池的电极名称不仅为电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是( )

A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,电极反应式为2H2O+2e-=2OH-+H2↑
C. ③中Fe作负极,电极反应式为Fe-2e-=Fe2+
D. ④中Cu作正极,电极反应式为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中理科化学试卷(解析版) 题型:选择题
在t℃时,将a gNH3完全溶解于水,得到VmL溶液.假设该溶液的密度为ρ g•cm-3,质量分数为ω,其中含NH4+的物质的量为b mol.下列叙述正确的是( )
A.溶质的质量分数ω=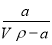 ×100%
×100%
B.溶质的物质的量浓度c=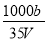 mol/L
mol/L
C.溶液中c(OH-)=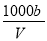 mol/L+ c(H+)
mol/L+ c(H+)
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com