
下列说法正确的是( )
|
| A. | 化学键的断裂和形成是化学反应的实质,化学反应前后能量不变 |
|
| B. | 凡是放热反应都是自发的,吸热反应都是非自发的 |
|
| C. | 若一个反应的平衡常数越大,则表示该反应速率也越大 |
|
| D. | 升高温度化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 |
| 反应热和焓变.. | |
| 专题: | 化学反应中的能量变化. |
| 分析: | A、任何化学反应前后都有能量变化; B、反应自发与否决定于焓变和熵变两方面; C、平衡常数可以表示反应正向进行程度,与反应速率无关; D、升高温度,分子能量增大,活化分子数目增多. |
| 解答: | 解:A、任何化学反应的反应物和生成物所含能量都不相同,故A错误; B、反应自发与否决定于焓变和熵变两方面,看△H﹣T△S的大小,故B错误; C、平衡常数越大反应正向进行的程度越大,反应速率不一定快,故C错误; D、升高温度,分子能量增大,活化分子数目增多,所以活化分子百分数增大,故D正确; 故选D. |
| 点评: | 本题考查了化学反应中能量变化的原因、反应自发与否的条件、化学平衡常数、活化分子的相关知识,题目难度不大. |


科目:高中化学 来源: 题型:
下列离子在给定的条件下能大量共存的是( )
|
| A. | 饱和氯水中:Cl﹣、NO3﹣、Na+、SO32﹣ |
|
| B. | 常温下, |
|
| C. | 0.1 mol/L的NaOH溶液中:K+、AlO2﹣、SO42﹣、CO32﹣ |
|
| D. | 在PH=7的溶液中:Fe3+、Na+、Br﹣、Cl﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的混合气体体积为(设反应中HNO3被还原成NO)( )
|
| A. | 0.448L | B. | 0.672L | C. | 0.896L | D. | 0.224L |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列设备工作时,将化学能转化为热能的是( )
| A | B | C | D |
|
|
|
|
|
| 硅太阳能电池 | 锂离子电池 | 太阳能集热器 | 燃气灶 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)=Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
|
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 |
|
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
|
| C. | 反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L•min) |
|
| D. | 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
电化学是研究电和化学反应相互关系的科学.电池、电解都存在我们熟知的电化学反应.
(1)如图1是一种常见的一次锌锰酸性干电池.干电池工作时,负极上的电极反应式是: ,
MnO2的作用是除去正极上的气体产物,本身生成Mn2O3,该反应的化学方程式是: .
(2)以碳棒为电极电解氯化铜溶液时发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出.
已知铜的化合物的颜色、性质如下:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液绿色,稀溶液蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
取电解CuCl2溶液后的阴极碳棒附着物,洗涤、干燥,连接如图2装置进行实验,验证阴极产物.
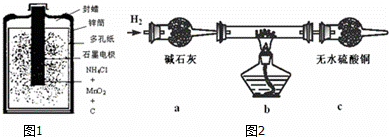
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.
①碳棒上的红色物质有无Cu2O? (填“有”或“无”),请简要说明的理由: .
②在c装置后将气体通入硝酸银溶液中,出现白色沉淀,说明根据表中性质推测的阴极碳棒上的少量白色物质一定存在.试写出上述装置b中发生反应的化学方程式: .
③由以上实验分析可知:电解CuCl2溶液的阴极上发生的电极反应式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时某溶液中含有大量Na+、H+、Fe3+、HC03﹣、OH﹣、I﹣中的几种,并且水 电离出的c(H+)=1×lO﹣13 mol/L.当向该溶液中缓慢通入一定量的Cl2后,溶液由无色 变为黄色.下列有关分析正确的是( )
|
| A. | 溶液的pH=1或13 | B. | 溶液中一定没有Fe3+,Na+ |
|
| C. | 溶液中阴离子有I﹣,不能确定HCO3﹣ | D. | 当Cl2过量,所得溶液只含有两种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作不正确的是 _。
A.在催化剂存在的条件下, 苯和溴水发生反应可生成无色、比水重的液体溴苯
B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验
C.乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇
D.试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,然后加热制取乙酸乙酯
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
G.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com