
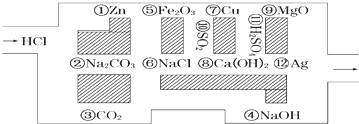
分析 (1)解决该题应该找出一条不能和盐酸发生反应的物质构成的路.酸的化学性质有:能够和酸碱指示剂变色,能够和活泼金属反应,能够和金属氧化物反应,能够和碱反应,能够和某些盐反应.活泼金属即在金属活动性顺序表中氢前的金属,酸和金属氧化物、碱、盐发生的反应是复分解反应;
(2)电解质:在水溶液中或熔融状态下能够导电的化合物;非电解质:在熔融状态和水溶液中都不能导电的化合物;
(3)根据物质的性质以及和盐酸之间的反应来回答;
(4)氧化铝是两性氧化物,既能和氢氧化钠反应又能和盐酸之间反应.
解答 解:(1)利用图示的物质对相关的与盐酸不能反应的物质作出判断即可,由于盐酸不能和二氧化碳、不活泼金属铜和银、氯化钠、二氧化硫、硫酸反应,故路线为:③→⑥→⑩→⑦→⑪→⑫,
故答案为:③→⑥→⑩→⑦→⑪→⑫;
(2)与盐酸不反应的有二氧化碳、不活泼金属铜和银、氯化钠、二氧化硫、硫酸,
二氧化碳和二氧化硫自身不能电离,属于非电解质;
铜和银是金属单质,既不是电解质也不是非电解质;
氯化钠在水溶液中或熔融状态下能够导电,属于电解质;
硫酸在水溶液中能够导电,属于电解质;
故属于电解质的是:⑥氯化钠,⑪硫酸;属于非电解质的是:③二氧化碳,⑩二氧化硫,
在能“吃掉”盐酸的物质中,②④⑤⑧⑨的水溶液或是在熔融状态下能导电,属于电解质;故答案为:③⑩;②④⑤⑧⑨;
(3)在盐酸走过的路径中,碳酸镁可以和硫酸之间发生反应而不能“走出”这个迷宫,反应为:MgCO3+2H+═Mg2++CO2↑+H2O;故答案为:不能;MgCO3+2H+═Mg2++CO2↑+H2O;
(4)氧化铝是两性氧化物,既能和氢氧化钠反应又能和盐酸之间反应,氧化铝与氢氧化钠反应方程式为:NaOH+Al(OH)3=Na[Al(OH)4];故答案为:NaOH+Al(OH)3=Na[Al(OH)4].
点评 本题主要考查酸的化学性质及,难度不大.注重培养学生对知识的应用能力和解决问题的能力.


科目:高中化学 来源: 题型:解答题
 4种相邻主族短周期元素的相对位置如表,元素X的核外电子数是元素M的2倍,Y的氧化物具有两性,回答下列问题.
4种相邻主族短周期元素的相对位置如表,元素X的核外电子数是元素M的2倍,Y的氧化物具有两性,回答下列问题. ,气体分子(MN)2的电子式:
,气体分子(MN)2的电子式: ,X形成的离子的电子式:Mg2+.
,X形成的离子的电子式:Mg2+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ①③⑥ | C. | ②⑥⑦ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16 gO2中含有的氧分子数为NA | |
| B. | 1 molOH-中含有的电子数为10NA | |
| C. | 标准状况下,11.2 L H2O中含有的氢原子数为NA | |
| D. | 1 mol/LBaCl2溶液中含有的钡离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NiOOH | B. | Ni(OH)2 | C. | Cd | D. | Cd(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净物都是由同种分子构成 | |
| B. | 纯净物可能是单质,也可能是化合物 | |
| C. | 矿泉水是纯净物 | |
| D. | 纯净物就是由同种元素组成的物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com