
| A. | 将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| B. | NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=2c(SO42-) | |
| C. | 0.1 mol•L-1CH3COOH溶液与0.1 mol•L-1CH3COONa等体积混合后pH<7,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | KNO3和CH3COONH4溶液pH均为7,两溶液中水的电离程度相同 |
分析 A.常温下,pH=3的醋酸浓度大于pH=11的NaOH浓度,二者等体积混合,醋酸有剩余,醋酸电离程度大于醋酸根离子水解程度导致溶液呈酸性;
B.NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(H+)=c(OH-),结合电荷守恒判断c(Na+)、c(SO42-)关系;
C.0.1 mol•L-1CH3COOH溶液与0.1 mol•L-1CH3COONa等体积混合后pH<7,说明醋酸电离程度大于醋酸根离子水解程度,但醋酸电离程度较小;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离.
解答 解:A.常温下,pH=3的醋酸浓度大于pH=11的NaOH浓度,二者等体积混合,醋酸有剩余,醋酸电离程度大于醋酸根离子水解程度导致溶液呈酸性,所以混合溶液pH<7,故A错误;
B.NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(H+)=c(OH-),溶液中存在电荷守恒c(Na+)+c(NH4+)=2c(SO42-),所以c(Na+)<2c(SO42-),故B错误;
C.0.1 mol•L-1CH3COOH溶液与0.1 mol•L-1CH3COONa等体积混合后pH<7,说明醋酸电离程度大于醋酸根离子水解程度,但醋酸电离程度较小,结合物料守恒得离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故C正确;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离,硝酸钾中钾离子、硝酸根离子都不影响水电离,醋酸铵中铵根离子和醋酸根离子都促进水电离,所以两种溶液中水电离程度不同,故D错误;
故选C.
点评 本题考查离子浓度大小比较、水电离影响因素等知识点,明确溶液中溶质及其性质、溶液酸碱性是解本题关键,结合电解质溶液中的电荷守恒和物料守恒来分析解答,题目难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 饱和NaHCO3溶液中通入过量CO2:CO32-+CO2+H2O═HCO3- | |
| B. | 金属铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | Ca(OH)2溶液与Na2CO3溶液反应:Ca2++CO32-═CaCO3↓ | |
| D. | 氯化铝与过量氨水反应:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测得新制氯水的pH为5 | |
| B. | 向某种消毒液(NaClO)中滴加盐酸,能抑制NaClO水解,降低漂白效果 | |
| C. | 铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用 | |
| D. | 为便于储存,需要将氯气液化[Cl2(g)?Cl2(l)],可以采取加压或者升温的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制成合金保护船体 | B. | 是外加电流的阴极保护法 | ||
| C. | 船体的反应:Fe-2e→Fe2+ | D. | 锌块的反应:Zn-2e→Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
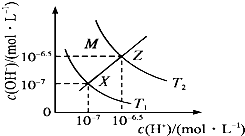
| A. | 由X→Z,c(OH-)增大,所以可以通过加碱来实现 | |
| B. | M区域内任意点均有c(H+)<c(OH-) | |
| C. | T1与T2两条曲线之间的任意点均有c(H+)×c(OH-)=10-14 | |
| D. | XZ线表示c(H+)=c(OH-),溶液显中性,所以XZ线上任意点均有pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯能发生取代反应、加成反应,还能使酸性KMnO4溶液褪色 | |
| B. | 分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种 | |
| C. | 甲苯中所有原子都处于同一平面 | |
| D. | 相同质量的甲烷和乙烷完全燃烧,乙烷耗氧量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池的电极是两种不同的金属 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 原电池负极发生的电极反应是还原反应 | |
| D. | 原电池的正极是还原剂,总是溶液中的阳离子在此被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com