

分析 Ⅰ.甲烷燃料电池中,负极上投放燃料甲烷,发生失电子发生氧化反应,正极上投放氧气,发生得电子的还原反应,注意电解质环境决定方程式的书写;
Ⅱ.Fe3+氧化性比Cu2+强,可发生2Fe3++Cu=2Fe2++Cu2+,反应中Cu被氧化,为原电池的负极,则正极可为碳棒或不如Cu活泼的金属,电解质溶液为氯化铁溶液,正极发生还原反应,负极发生氧化反应,以此解答该题.
解答 解:Ⅰ.若电解质溶液为KOH溶液,负极上投放燃料甲烷,发生失电子发生氧化反应:CH4-8e-+10OH-═CO32-+7H2O,若以稀硫酸为电解质溶液,正极上投放氧气,发生得电子的还原反应:O2+4e-+4H+=2H2O,
故答案为:CH4+10OH--8e-=CO32-+7H2O,O2+4e-+4H+=2H2O,
Ⅱ.(1)Fe3+氧化性比Cu2+强,可发生2Fe3++Cu=2Fe2++Cu2+,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,故答案为:Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+;
(2)Fe3+氧化性比Cu2+强,可发生2Fe3++Cu=2Fe2++Cu2+,Cu被氧化,为原电池的负极,正极Fe3+被还原,正极可为碳棒,电解质溶液为氯化铁,
则原电池装置图可设计为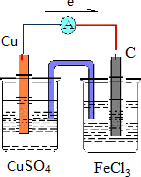 ,电子从铜极流向碳极,故答案为:
,电子从铜极流向碳极,故答案为: ;
;
(3)该装置反应一段时间后,当溶液的质量增加3.2g时,即消耗的金属铜质量是3.2g即0.05mol,根据负极反应Cu-2e-=Cu2+,电子转移0.1mol,故答案为:0.1mol.
点评 本题考查了化学电源新型电池,根据得失电子确定正负极上通入的气体,难点是电极反应式的书写,注意碱性条件下甲烷失电子不能生成氢离子,要生成碳酸根离子,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{92}^{235}U$是核电站的主要原料,2.35g${\;}_{92}^{235}U$的中子数为0.92NA | |
| B. | ${\;}_{53}^{131}I$具有放射性,1.31g${\;}_{53}^{131}I$具有的中子数为0.78NA | |
| C. | 标准状况下,11.2L氦气中约含有NA个氦原子 | |
| D. | 0.1mol•L-1Na2CO3溶液中含有0.1NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示的装置在实验室中用途比较广泛:
如图所示的装置在实验室中用途比较广泛:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
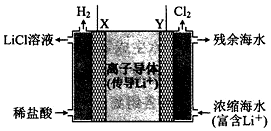 浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )
浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )| A. | 电池工作时,Li+通过离子电子导体移向b区 | |
| B. | 电流由X极通过外电路移向Y极 | |
| C. | 正极发生的反应为:2H++2e-=H2↑ | |
| D. | Y极每生成1 mol Cl2,a区得到2 mol LiCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14 g丙烯和环丙烷混合气体中碳原子数为NA | |
| B. | 标准状况下,11.2 L乙烷含有共价键数为3NA | |
| C. | 密闭容器中充入1 mol I2(g)和2 mol H2(g)充分反应,生成HI分子数为2NA | |
| D. | Na2O2与CO2反应时,生成0.5 mol O2转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了防止白色污染应将废旧塑料加以焚烧 | |
| B. | 加热能杀死H7N9禽流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 富脂禽品包装中常放入活性铁粉袋,以防止油脂氧化变质 | |
| D. | 用K2FeO4代替Cl2处理饮用水时,既有杀菌消毒作用,又有净水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:b>c>a | |
| B. | 常温下5.0×10-3mol•L-1KHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A) | |
| C. | 室温时,M(OH)2(s)?M2+(aq)+2OH-(aq) Ksp=a; c(M2+)=b mol•L-1时,溶液的pH等于14 | |
| D. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键 | B. | 极性共价键 | C. | 非极性共价键 | D. | 范德华力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com