
| A. | $\frac{4M}{{a}^{3}}$ | B. | $\frac{M}{{a}^{3}{N}_{A}}$ | C. | $\frac{2M}{{a}^{3}{N}_{A}}$ | D. | $\frac{4M}{{a}^{3}{N}_{A}}$ |
分析 每个顶点上的二氧化碳分子被8个晶胞共用,每个面心上的二氧化碳分子被两个晶胞共用,所以该晶胞中二氧化碳分子个数=$8×\frac{1}{8}+6×\frac{1}{2}$=4,根据ρ=$\frac{m}{V}$=$\frac{\frac{4M}{{N}_{A}}}{V}$计算即可.
解答 解:每个顶点上的二氧化碳分子被8个晶胞共用,每个面心上的二氧化碳分子被两个晶胞共用,所以该晶胞中二氧化碳分子个数=$8×\frac{1}{8}+6×\frac{1}{2}$=4,ρ=$\frac{m}{V}$=$\frac{\frac{4M}{{N}_{A}}}{V}$=$\frac{\frac{4Mg/mol}{N{\;}_{A}}}{(acm)^{3}}$=$\frac{4M}{{a}^{3}{N}_{A}}$g/cm3,
故选:D.
点评 本题考查了晶胞的计算,利用均摊法计算晶胞中含有的二氧化碳分子个数,再根据密度公式计算其密度即可,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有乙烯 | B. | 可能有甲烷 | ||
| C. | 可能有乙烷 | D. | 一定是甲烷和乙烯的混和物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
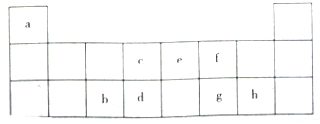 如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 144.0 g CuSO4 | B. | 144.0 g CuSO4•5H2O | ||
| C. | 225.0 g CuSO4•5H2O | D. | 250.0 g CuSO4•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu溶于稀HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| B. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×10-8mol/L | B. | 1×10-6mol/L | C. | 2×10-8mol/L | D. | 1×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 +CH3Br$\stackrel{催化剂}{→}$
+CH3Br$\stackrel{催化剂}{→}$ -CH3+HBr;
-CH3+HBr; .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ .
. +
+ $→_{△}^{浓硫酸}$H2O+
$→_{△}^{浓硫酸}$H2O+ .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com