
【题目】常温下,向1LpH=10的NaOH溶液中持续通入CO2。通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示。下列叙述不正确的是( )

A. a点溶液中:水电离出的c(H+)=1×10-10mol·L-1
B. b点溶液中:c(H+)=1×10-mmol·L-1
C. c点溶液中:c(Na+)>c(HCO3-)>c(CO32-)
D. d点溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂,下图为制备粗高铁酸钾的工业流程。
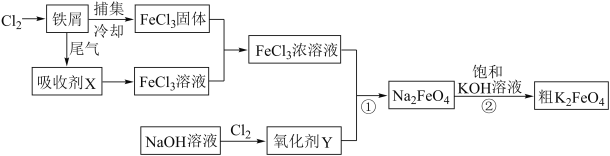
请回答下列问题:
(1)氯化铁做净水剂的原因是(结合化学用语表达) 。
(2)吸收剂X的化学式为 ,氧化剂Y的化学式为 。
(3)碱性条件下反应①的离子方程式为 。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+NaFeO4=K2FeO4+2NaOH,请根据反应原理分析反应能发生的原因 。
(5)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
A.H2O B.稀KOH溶液 C.NH4Cl溶液 D.Fe(NO3)3溶液
除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是 。
(6)高铁电池是正在研制中的充电电池,具有电压稳定、放电时间长等优点。以高铁酸钾、二氧化硫和三氧化硫为原料,硫酸钾为电解质,用惰性电极设计成能在高温下使用的电池,写出该电池的正极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化物的叙述正确的是
A. 金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B. 酸性氧化物都能与水化合生成酸
C. 碱性氧化物都能与水化合生成碱
D. 碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、N、O、Na、S、Cl都是中学化学中的常见元素,根据题意回答与这些元素有关的问题:
(1)画出Na原子结构示意图_______,Na2O2可用作供氧剂,其电子式为_______。
(2)Cl2是一种大气污染物,装有液氯的钢瓶上应贴的标签是_______(填编号)。

氯气泄漏可用NaHSO3溶液来处理,写出相关的离子反应方程式_____________。
(3)25C时,利用pH试纸测得0.1mol/L氨水的pH约为11,则可以估算出氨水的电离常数约为_____;向10mL此溶液中通入少量氨气,忽略溶解过程中溶液温度和体积的微小变化,溶液中![]() 将_______(填“增大” “减小”或“无法确定”)。
将_______(填“增大” “减小”或“无法确定”)。
(4)有两种化合物同时含有上述六元素中的四种元素。将这两种化合物的溶液混合后,恰好完全反应,生成物之一M仍含有这四种元素,该反应的离子方程式为______________。若M溶液的pH =5,则由水电离出的c(H+)=_______mol/L,该溶液离子浓度由大到小的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器里,A与B反应生成C,其反应速率分别用VA、VB、VC表示,已知2VB=3VA ;3VC=2VB 。则此反应可表示为
A、2A+3B=2C B、A+3B=2C C、3A+B=2C D、A+B=C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:
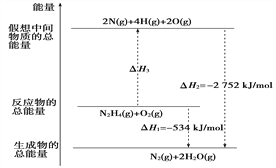
A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的污水只可能含Na+、K+、NH4+、Mg2+、Fe3+、SO32-、SO42-和Cl-中的几种(忽略由水电离产生的H+、OH-)。将试样平均分成甲、乙、丙各l00mL三份,每次均加入足量的试剂,设计如下实验。下列说法正确的是( )

A. 废水可能含有Na+、K+、Fe3+
B. 可能存在的离子用焰色反应进一步检验确认
C. 废水一定含有Cl-、SO42-和Mg2+,且c(Cl-)=0.2mol·L-1
D. 废水一定不含 SO32-、Cl-、NH4+、Na+、K+、Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中只含K+、Fe2+、Cl-、SO42-四种离子.已知K+、Fe2+、Cl-的个数比为3:2:1,则溶液中Fe2+与SO42-的个数比为( )
A.2:3 B.1:4 C.1:1 D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减缓锌和一定浓度盐酸的反应速率,而又不减少产生氢气的量,向盐酸中加入下列物质或措施可行的是( )
A. 升温 B. NaF溶液 C. NaNO3溶液 D. 几滴CuSO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com