
【题目】下列制备金属单质的方法或原理正确的是( )
A. 在高温条件下,用H2还原MgO制备单质Mg
B. 在通电条件下,电解熔融Al2O3制备单质Al
C. 在通电条件下,电解饱和食盐水制备单质Na
D. 加强热,使CuO在高温条件下分解制备单质Cu
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】锌—空气电池是金属空气电池的一种,电解质溶液为KOH溶液时,反应为:2Zn+O2+4OH-+2H2O=2Zn(OH)42-。下列有关说法正确的是
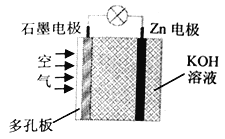
A. 石墨电极上发生氧化反应 B. 正极附近溶液的pH不断减小
C. OH-由锌电极移向石墨电极 D. Zn 电极上发生反应:Zn-2e-+4OH-=Zn(OH)42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解可得烃D,其产量是一个国家石油化工发展水平的标志,已知D在标准状况下的密度为1.25 g·Lˉ1。有机物B可利用植物秸秆来生产,E为有香味的油状液体,它们之间的转化关系如图,请回答:

(1)C中所含官能团名称是____。
(2)写出反应④的化学方程式____。
(3)C与D在一定条件下可发生加成反应,生成具有酸性的物质F。F的结构简式为___。
(4)下列说法正确的是____。(填编号)
A.有机物E与F互为同分异构体
B.用新制氢氧化铜悬浊液无法区分有机物B和C
C.有机物A、D均能被酸性高锰酸钾溶液氧化
D.可用饱和NaOH溶液除去有机物E中混有的少量B、C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
![]() (浓)
(浓)![]()
![]()
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于________(用字母代号填写)
a. 酸 b. 碱 c. 盐 d. 酸性氧化物 e. 碱性氧化物
A物质可以使酸性![]() 溶液褪色,此反应中________(填写化学式,下同)失去电子,氧化剂是__________。
溶液褪色,此反应中________(填写化学式,下同)失去电子,氧化剂是__________。
(2)一定量的铜片与100mL 18 mol/L的浓![]() 充分反应,如果该反应过程中转移了0.2mol电子,生成的
充分反应,如果该反应过程中转移了0.2mol电子,生成的![]() 的质量为_____g。
的质量为_____g。
(3)将反应后所得到的溶液与足量![]() 溶液充分反应。请写出此过程发生的反应的离子方程式:______________________。
溶液充分反应。请写出此过程发生的反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的氧化物、氮的氧化物是严重的大气污染物,可以通过以下方法处理:
催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
(l)已知:N2(g)+O2(g)![]() 2NO(g) △H=+180kJ/mol
2NO(g) △H=+180kJ/mol
化学键 | O=O | C=O | C≡O | N≡N |
键能(kJ/mol) |
则反应:2N0(g)+2CO(g)![]() N2(g)+2CO2(g) △H=________kJ/mol。
N2(g)+2CO2(g) △H=________kJ/mol。
(2)氮氧化物和碳氧化物在催化剂作用下可发生反应:2C0+2NO(g) ![]() N2+2CO2,在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=______。
N2+2CO2,在体积为1L的密闭容积中,加入0.80mol的CO和0.80 mol的NO,反应中N2的物质的量浓度的变化情况如下左图所示,从反应开始到平衡时,NO的平均反应速率v(NO)=______。

(3)用CO2合成二甲醚的化学反应是:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。
CH3OCH3(g)+3H2O(g) △H>0。合成二甲醚时,当氢气与二氧化碳的物质的量之比为4:l, CO2的转化率随时间的变化关系如图所示。
①A点的逆反应速率v逆(CO2)_____B点的正反应速率为v正(CO2)(填“>”、“<”或 “=”)。
(4)SO2可用氢氧化钠来吸收。现有0.4molSO2,若用200mL 3mol·L-1NaOH溶液将其完全吸收,生成物为_____(填化学式)。经测定所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为________。
(5)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:_________。
(6)己知常温下Fe(OH)3的Ksp=4.0×10-38。若某氢氧化镁溶液的PH=9,则该溶液中c(Fe3+)最大为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼在元素周期表中的位置为_________,电子排布式是________,硼元素有两种天然同位素10B和11B,硼元素的近似相对原子质量为10.8,则两种同位素原子的原子个数之比为_______。
(2)单质硼(B)在一定条件下与NaOH溶液反应生成NaBO2和一种气体,请写出该反应的化学方程式________________。
(3)硼酸(H3BO3)是一种白色片状晶体,微溶于水,对人体的受伤组织有着和缓的防腐消毒作用。硼酸是一元弱酸,室温时0.1mol/L硼酸的pH为5,计算硼酸的电离常数K=__________。氟硼酸(HBF4)是一种强酸,仅以离子状态存在于水中,请写出BF4﹣的电子式__________。
(4)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。
①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构_________(填“相同”或“不相同”)。
②B2H6可由BF3与NaBH4在一定条件下反应制得,写出该反应的化学方程式_________。
③B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能作为判断氯、磷两种元素非金属性强弱的依据的是( )
A. 氧化性:Cl2>红磷 B. 单质沸点:红磷>Cl2
C. 氢化物稳定性:HCl>PH3 D. 酸性:HClO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是 ( )

A. 正硼酸晶体属于原子晶体
B. H3BO3分子的稳定性与氢键有关
C. 分子中硼原子最外层为8电子稳定结构
D. 含1 mol H3BO3的晶体中有3 mol氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:
2SO2(g)+O2(g) ![]() 2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是________。
SO2 压强 转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2mol SO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。2.0 molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”), B点的化学平衡常数是______。

(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2, t1时刻达到平衡,测得容器中含SO30.18mol。
① tl 时刻达到平衡后,改变一个条件使化学反应速率发生如图所示的变化,则改变的条件是________。
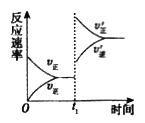
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
② 若继续通入0.20mol SO2和0.10molO2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”) ,再次达到平衡后,______mol3)<______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com