
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
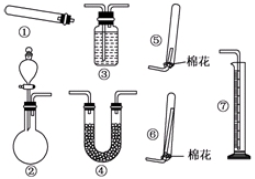
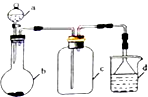 根据如图装置和表中提供的物质完成实验室制取、收集表中气体并进行尾气处理 (省略夹持、加热及净化装置),最合理的选项是( )
根据如图装置和表中提供的物质完成实验室制取、收集表中气体并进行尾气处理 (省略夹持、加热及净化装置),最合理的选项是( )| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 稀硫酸 | 石灰石 | CO2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
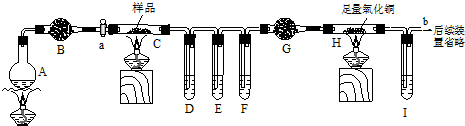
查看答案和解析>>
科目:高中化学 来源: 题型:

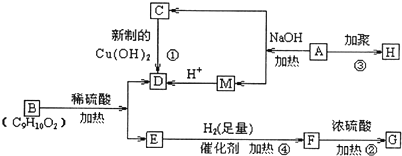
查看答案和解析>>
科目:高中化学 来源: 题型:
| 175℃ |
| △ |
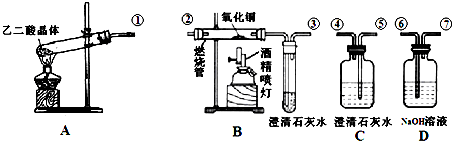
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试剂组合 | ①Ca(OH)2 NH4Cl | ②Ca(OH)2(NH4)2SO4 | ③CaO NH4Cl | ④CaO(NH4)2SO4 |
| NH3体积( mL) | 1344 | 1364 | 1792 | 1753 |
| 实际产量 |
| 理论产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.2 g |
| B、(2m-3.2)g |
| C、(m-1.6)g |
| D、(2m-1.6)g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com