
【题目】绿色化学又称环境友好化学,它的主要特点之一是提高原子的利用率,使原料中所有的原子全部 转化到产品中,实现“零排放”。下列反应符合绿色化学这一特点的是
A. 工业冶炼 Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
B. 用生石灰制熟石灰 CaO+H2O=Ca(OH)2
C. 实验室制取二氧化碳 CaCO3+2HCl=CaCl2+H2O+CO2↑
D. 实验室制取氢气 Zn+H2SO4=ZnSO4+H2↑
【答案】B
【解析】
绿色化学又称环境友好化学,它的主要特点之一是提高原子的利用率,使原料中所有的原子全部转化到产品中,即原子利用率达到100%。
A. 工业冶炼Fe2O3+3CO![]() 2Fe+3CO2中生成物是两种,原子利用率没有达到100%,A错误;
2Fe+3CO2中生成物是两种,原子利用率没有达到100%,A错误;
B. 用生石灰制熟石灰CaO+H2O=Ca(OH)2中生成物只有一种,原子利用率达到100%,B正确;
C. 实验室制取二氧化碳CaCO3+2HCl=CaCl2+H2O+CO2↑中生成物是三种,原子利用率没有达到100%,C错误;
D. 实验室制取氢气Zn+H2SO4=ZnSO4+H2↑中生成物是两种,原子利用率没有达到100%,D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】已知:25℃时,H2SO3 Ka1=1.5×10-2 Ka2=1.0×10-7 H2CO3 Ka1=4.4×10﹣7 Ka2=4.7×10-11 HClO Ka=3.0×10﹣8 饱和 NaClO 溶液的浓度约为 3mol/L.
(1)室温下,0.1mol/L NaClO 溶液的 pH _____0.1mol/L Na2SO3 溶液的 pH.(选填“大于”、小于”或“等于”)。浓度均为 0.1mol/L 的 Na2SO3 和 Na2CO3 的混合溶液中,SO32﹣、CO32﹣、HSO3﹣、HCO3﹣浓度从大到小的顺序为_______________。
(2)下列离子反应正确的有:__________。
A.2HCO3﹣+SO2═SO32﹣+2CO2+H2O B.ClO﹣+CO2+H2O═HClO+HCO3﹣
C.ClO﹣+SO2+H2O═HClO+HSO3﹣ D.2ClO﹣+SO2+H2O═2HClO+SO32﹣
(3)某消毒液的有效成分为 NaClO,还含有一定量的 NaOH 等,下列用来解释事实的方程式中不合理的是:__________。
A.该消毒液可用 NaOH 溶液吸收 Cl2 制备:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
B.室温下,该消毒液的 pH 约为12,主要是因为:ClO﹣+H2O![]() HClO+OH﹣
HClO+OH﹣
C.该消毒液加白醋生成 HClO,可增强漂白作用:H++ClO﹣═HClO
D.该消毒液与洁厕灵(主要成分为 HCl)混用,产生 Cl2:2H++Cl﹣+ClO﹣═Cl2↑+H2O
(4)25℃时,0.1mol 下列气体分别与 1L0.l mol·L﹣1 的 NaOH 溶液反应,形成的溶液的pH 由大到小的顺序为:_________(用 A、B、C 表示).
A.SO3 B.SO2 C.CO2
(5)下列说法不正确的是(_____)
A.一定温度下,pH相同的氨水和氢氧化钠等体积混合后溶液pH不变
B.含等物质的量的 NaClO、NaHCO3 混合溶液中:c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)+c(CO32﹣)
C.CH3COOH 溶液加水稀释后,溶液中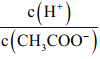 的值减小
的值减小
D.水中加入金属钠,虽反应生成了强碱氢氧化钠,但促进了水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e-![]() Cu
Cu
C. 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某浓度的碳酸中含碳微粒的物质的量浓度的对数值与溶液的pH的关系如下图所示。下列说法正确的是( )
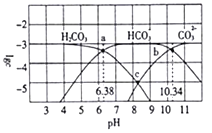
A. lgKa1(H2CO3)=6.38
B. C点对应溶液的pH=8.36
C. 溶液的pH=8时,c(HCO3-)>c(OH-)>c(CO32-)
D. 25℃时,反应CO32-+H2CO3=2HCO3-的平衡常数对数值1gK=-6.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中(假定不考虑水解因素)仅含有K+、Mg2+、SO42﹣、NO3﹣四种离子,其中K+与Mg2+的个数之比为4:5,则NO3﹣与SO42﹣的物质的量浓度之比一定不是( )
A.8:3
B.3:2
C.1:3
D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烯的分子式可写成(CH2)2
B.乙烯的结构简式为CH—CH
C.乙烯与HCl反应生成CH3CH2Cl
D.乙烯的结构简式为CH2CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室溫下,0.25molC2H4(g)完全燃烧生成二氧化碳和液态水,放出352.75kJ的热量。请写出该反应的热化学方程式:_________________。为了缓解温空效应,科学家提出了多种回收和利用CO2的方案。
方案1: 利用FeO吸收CO2获得H2
ⅰ.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH1=-76.0kJ/mol
ⅱ.C(s)+2H2O(g)=CO2(g)+2H2(g) ΔH2 = + 113. 4kJ/mol
(1) 3FeO(g)+H2O(g)= Fe3O4(s)+H2(g) ΔH3 =__________
(2) 在反应i中,每放出38.0kJ热量有____________gFeO被氧化。
室温下,物质的量浓度均为0.lmol/L 的几种盐溶液的pH如下表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(3)写出溶液④中通入少量CO2的离子方程式:__________
(4)25℃时,溶液①中,由水电离产生的c(OH-)=_____mol/L。
(5)下列说法正确的是__________ (填序号)。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3-)+c(CO32-)=0.1mol/L
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
方案2:利用CO2制备CH4
300℃时,向2L恒容密闭容器中充入2molCO2和8molH2发生反应:CO2(g)+4H2(g)![]() CH4(g)+ 2H2O(g)ΔH4,混合气体中CH4的浓度与反应时间的关系如图所示。
CH4(g)+ 2H2O(g)ΔH4,混合气体中CH4的浓度与反应时间的关系如图所示。

(6)①从反应开始到恰好达到平衡时,H的平均反应速率v(H2)=____________。
②300℃时,反应的平衡常数K=____________。
③保持温度不变,向平衡后的容器中再充入2molCO2和8molH2,重新达到平衡时CH4的浓度__(填序号)。
A.等于0.8mo/L B.等于1.6mo/L
C.0.8mol/L4)<1.6mol/L D.大于1.6mol/L
(7)300℃时,如果该容器中有1.6molCO2、2.0molH2、5.6molCH4、4.0molH2O(g).则v正___v逆
(填“>”“<”或“=" )。
(8)已知:200℃时,该反应的平衡常数K=64.8L2·mol-2。则ΔH4____0(填“>”“<”或“=”)。
方案3:利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

(9)①放电时,正极的电极反应式为____________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mole-时,两极的质量差为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
B. 标准状况下,2.24LSO3分子数为0.1NA
C. 加热条件下,1 mol Fe投入足量的浓硫酸中,生成NA个SO2分子
D. 0.1molNa2O2与足量潮湿的二氧化碳反应转移的电子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com