
【题目】在50mL18molL﹣1的浓H2SO4中加入足量的Cu片并加热,充分反应后,被还原的H2SO4的物质的量为( )
A. 等于0.9mol B. 等于0.45mol C. 大于0.45mol,小于0.9mol D. 小于0.45mol
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三套实验装置,分别回答下列问题。
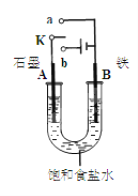
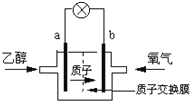
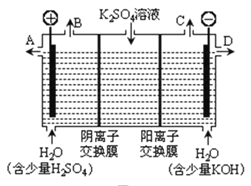
图1图2图3
(1)图1中,① 若开始时开关K与a连接,则该装置为_____(填装置名称),电极A的电极反应式为________________________
②若开始时开关K与b连接,则总反应的离子方程式为 ___________________________
(2)2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,电池示意如图2所示:
①______极(填a或b)为电池的正极,电池工作时电流方向为_________(填a→b或b→a)
②写出该电池负极的电极反应式________________________________________
(3)用图3装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阴极反应式为_____________________。
②制得的硫酸溶液从出口____(填“A”、“D”)导出,并简述原因__________________________(请用化学用语和文字解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室配制1000mL0.50mol·L-1的Na2CO3溶液,在常用仪器中应选用______mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度______0.50mol·L-1(填“大于”、“小于”或“等于”)。
(2)配制完毕后,用标准Na2CO3溶液滴定未知浓度的盐酸时,Na2CO3溶液应装在______式滴定管中。若采用上述标准Na2CO3溶液滴定,滴定时实验数据列表如下:
次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
1 | 20.00 | 18.80 |
2 | 20.00 | 16.95 |
3 | 20.00 | 17.05 |
则c(HCl)=______mol·L-1。
(3)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度______,若原来配制所称取的Na2CO3固体中混有Na2CO3·10H2O,则实验误差为______(以上两空填“偏高”、“偏低”或“无影响”)
(4)常温下向20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液pH逐渐降低,此时溶液中含碳元素的微粒的物质的量浓度的百分含量(纵轴)发生的变化(CO2因逸出未画出)如图所示,根据图示回答下列问题:

①请写出AB段反应的离子方程式___________________________________
当反应到A点时,溶液中所有阳离子和阴离子的浓度大小关系为(氯离子浓度除外)_____________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2反应制备二甲醚(CH3OCH3)的条件是压力2.0~10.0MPa,温度300℃。设备中进行下列反应,请回答下列问题:
①CO(g)+2H2(B)![]() CH3OH(g) △H=-90.7kJ/mol
CH3OH(g) △H=-90.7kJ/mol
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
(1)总反应3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g)的△H=_____________ 。据此可判断该反应_________________条件下自发。
(2)在温度和容积不变的条件下发生反应①,能说明该反应达到平衡状态的依据是_____
a.容器中压强保持不变 b.混合气体中c(CO)不变
c.v正(CO)= v逆(H2) d.c(CH3OH)= c(CO)
(3)在2L 的容器中加入amol CH3OH(g)发生反应②,达到平衡后若再加入amolCH3OH(g)重新达到平衡时,CH3OH 的转化率____________(填“增大”、“ 减小”或“不变”)。
(4)850℃时在一体积为10L 的容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示。
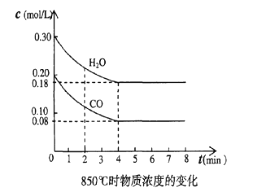
①0~4min 的平均反应速率,v(CO)=________________ 。
②若温度不变,向该容器中加入4mo1CO(g)、2mo1H2O(g)、3mo1CO2(g)和3molH2(g),起始时v正(CO)______v逆(H2)(填“<”、“ >”或“=”),请结合必要的计算说明理由。________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学工作者研发了一种SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法不正确的是

A. 过程Ⅰ得到的Li3N中N元素为-3价
B. 过程Ⅱ生成W的反应:Li3N+3H2O===3LiOH+NH3↑
C. 过程Ⅲ中能量转化的形式:化学能转变为电能
D. 过程Ⅲ涉及到反应:4OH-4 e-=== O2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com