
����Ŀ��������þ�㷺������ȼ��������������ʯ����ѧʽ��MgCO3CaCO3��Ϊԭ���Ʊ�������þ�Ĺ����������£� 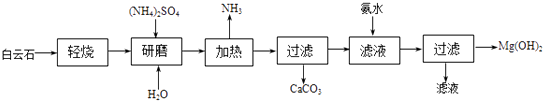
��1����������ͼ������ʯ�����ա��ֽ�Ļ�ѧ��Ӧʽ�� ��
��2������ĥ����Ŀ���� ��
��3�����백ˮʱ��Ӧ�Ļ�ѧ����ʽΪ������Mg��OH��2�����Ƿ�ϴ�Ӹɾ��ķ����� ��
��4���������п���ѭ�����õ������� ��
��5����ͳ�����ǽ�����ʯ���·ֽ�Ϊ����þ�������ƺ���ȡ�����ù��ղ������հ���ʯ�ķ��������ŵ��� ��
���𰸡�
��1��MgCO3=��=MgO+CO2��
��2������Ӧ��֮��ĽӴ��������Ӧ�ٶȿ��ҳ��
��3��MgSO4+2NH3?H2O=Mg��OH��2��+��NH4��2SO4��ȡ�������һ��ϴ��Һ���������ữ���ټ����Ȼ�����Һ�����������ɣ�˵����ϴ��
��4����NH4��2SO4��NH3
��5��������Դ���ģ����ڷ����CaCO3
���������⣺��1���ӹ����п��Եõ�CaCO3���������жϣ���֪�ֽ��ֻ��̼��þ���ֽ���������þ������ʽΪMgCO3=��=MgO+CO2���� ���Դ��ǣ�MgCO3=��=MgO+CO2������2������ĥ����������Ӧ��֮��ĽӴ��������Ӧ�ٶȿ��ҳ�֣����Դ��ǣ�����Ӧ��֮��ĽӴ��������Ӧ�ٶȿ��ҳ�֣���3�����백ˮ������������þ����������ʽΪMgSO4+2NH3H2O=Mg��OH��2��+��NH4��2SO4������ϴ�Ӹɾ��ķ�����ȡ���һ��ϴ��Һ�����Ƿ�����������ӣ�ϴ��Mg��OH��2�������ò���������©�����ձ��������ȣ�ȡϴ��Һ�����Ȼ�����Һ�����������ɣ�˵����ϴ�������Դ��ǣ�MgSO4+2NH3H2O=Mg��OH��2��+��NH4��2SO4��ȡ�������һ��ϴ��Һ���������ữ���ټ����Ȼ�����Һ�����������ɣ�˵����ϴ������4��������ͼ��֪����NH4��2SO4 ��NH3����ѭ�����ã����Դ��ǣ���NH4��2SO4 ��NH3����5���������̿�֪����ͳ���ս�����ʯ�ֽ�Ϊ����þ�������ƺ���ȡ���ù��ղ������հ���ʯ�ķ������Լ�����Դ���ġ�����CaCO3���룻���Դ��ǣ�������Դ���Ļ����CaCO3���룻���Դ��ǣ�������Դ���ģ����ڷ����CaCO3 �����CO2���ŷţ�


 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������
��1�������£�0.1mol/LHCl��Һ��pH=��0.005mol/LBa��OH��2��Һ��pH=��
��2�������£�pH=13��Ba��OH��2��ҺaL��pH=3��H2SO4��ҺbL��ϣ���Ϻ���Һ����仯���Բ��ƣ�
�������û����Һ�����ԣ���a��b=��
�������û����ҺpH=12����a��b= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4��Ӧ�У���������Pԭ���뱻��ԭ��Pԭ�Ӹ������� �� ��
A. 11:5 B. 5:6 C. 6:5 D. 11:6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���þ۹��ֵ�Ͳ�������з�ɢϵ�����ܹ۲쵽�����ЧӦ���ǣ� ��
A.Fe(OH)3����
B.��������Һ
C.KOH��Һ
D.������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ᾧˮ���ﺬ�����������Ӻ�һ�������ӣ���ȡ����������Ϊ1.96g�ĸýᾧˮ����ֱ��Ƴ���Һ�� һ�ݼ�������Ba��OH��2��Һ�����ɰ�ɫ�������漴������Ϊ����ɫ�������к��ɫ�����ȸû����ݳ�0.224L����״������ʹʪ��ĺ�ɫʯ����ֽ���������壻��ϡ���ᴦ���������ϴ�Ӻ���õ���ɫ����2.33g��
��һ�ݼ��뺬0.001molKMnO4��������Һ��MnO4��ǡ����ȫ����ԭΪMn2+ ��
��ش��������⣺
��1���ýᾧˮ�����к��е��������������� �� �������� ��
��2���ýᾧˮ����Ļ�ѧʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.Kspֻ�����ܵ���ʵ����ʺ��¶��й�
B.����Ksp��ZnS����Ksp��CuS��������ZnS������һ�������¿�ת��ΪCuS����
C.���ܵ����Mg��OH��2��Ksp=c�� Mg2+��?c��OH����
D.25�棬Ksp��AgCl��=1.8��10��10 �� ��AgCl����ˮ��Һ��ϵ��c��Ag+��Ϊ ![]() ��10��5mol/L
��10��5mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�����ƿ�������в���ȷ���� �� ��
A. ������һ���̶��� B. ϸ�������Ρ�ƽ������ĥ�ڲ�����
C. ����ʹ���¶� D. �������ʵ���Ũ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com