
【题目】在1L的密闭容器中通入2mol NH3,在一定温度下发生下列反应:2NH3![]() N2+3H2,达到平衡时,容器内N2的百分含量为a%。若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内
N2+3H2,达到平衡时,容器内N2的百分含量为a%。若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内![]() 的百分含量也为a%的是( )
的百分含量也为a%的是( )
A.3mol H2+2mol N2B.2mol NH3+1mol N2
C.3mol N2+1mol H2D.0.lmol NH3+0.95mol N2+2.85mol H2
【答案】D
【解析】
据等效平衡,按化学计量数转化到方程式的左边,满足n(NH3)=2mol,则达到平衡时,容器内N2的百分含量为a%;
A.3mol H2+2mol N2按化学计量数转化到方程式的左边可得:n(NH3)=2mol、n(N2)=1mol,不属于等效平衡,故A错误;
B.2mol NH3+1mol N2与初始量2mol NH3不相同,则不属于等效平衡,达到平衡时,容器内N2的百分含量不是a%,故B错误;
C.3mol N2+1mol H2按化学计量数转化到方程式的左边,不满足n(NH3)=2mol,与初始初始加入物质不同,不是等效平衡,故C错误;
D.0.1mol NH3+0.95mol N2+2.85mol H2,按化学计量数转化到方程式的左边,满足n(NH3)=2mol,属于等效平衡,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】由反应物X转化为Y和Z的能量变化如图所示。下列说法错误的是( )
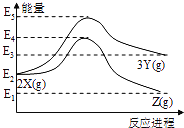
A. 由![]() 反应的ΔH >0
反应的ΔH >0
B. 由![]() 反应的ΔH = (E2-E1) kJ/mol
反应的ΔH = (E2-E1) kJ/mol
C. 降低压强有利于提高Y的产率
D. 降低温度有利于提高Z的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知单质铜与稀硝酸的反应为3Cu+8HNO3===2NO↑+4H2O+3Cu(NO3)2(Cu的相对原子质量为64)。现把19.2 g Cu放入200 mL 5 mol·L-1硝酸中,充分反应,问:
(1)哪种物质过量?______
(2)参加反应的硝酸的物质的量为多少?______
(3)在标准状况下产生的气体的体积为多少?______
(4)生成水的分子数为多少?______
(5)若反应前后溶液的体积不变,则生成Cu(NO3)2的物质的量浓度为多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.3g钠投入到97.8g水中,反应完毕后,得到100mL的溶液。求:
(1)产生氢气在标况下的体积_____。
(2)所得氢氧化钠溶液的溶质质量分数______。
(3)所得氢氧化钠溶液的物质的量浓度_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列曲线中,纵坐标表示生成氢氧化铝的量,横坐标表示加入试剂的体积。从下边图中选出选项:
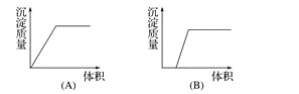
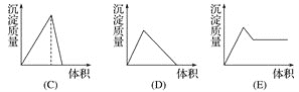
(1)向盐酸酸化的氯化铝溶液中逐滴滴入氨水至过量__________。
(2)向氢氧化钠与偏铝酸钠混合液中通入二氧化碳过量__________。
(3)向氨水中逐滴滴入氯化铝溶液至过量__________。
(4)向氯化铝溶液中滴加氢氧化钠至过量__________。
(5)向偏铝酸钠溶液滴加盐酸至过量______________。
(6)向氯化镁和氯化铝混合液中加氢氧化钠至过量____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
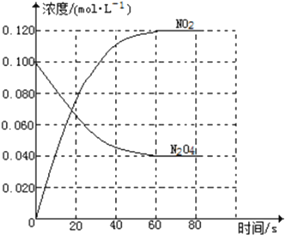
回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为___________molL-1s-1反应的平衡常数K1为___________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____。
②列式计算温度T是反应的平衡常数K2___________
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___________(填“正反应”或“逆反应”)方向移动,判断理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含原子个数比为__,分子的物质的量之比为__。
(2)等温、等压下,等体积的O2和O3所含分子个数比为__,质量比为___。
(3)设NA为阿伏加德罗常数的数值,如果ag氧气中含有的分子数为b,则cg氧气在标准状况下的体积约是___(用含NA的式子表示)。
(4)常温下,将20g质量分数为14%的KNO3溶液跟30g质量分数为24%的KNO3溶液混合,得到密度为1.15g·cm-3的混合溶液。该混合溶液的物质的量浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A. ①④⑥B. ①②④C. ②③⑤D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强。利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法错误的是
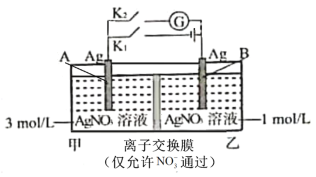
A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池Ag+浓度相等
B.断开K1、闭合K2,当转移0.1mol e-时,乙池溶液质量增加17.0 g
C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com