
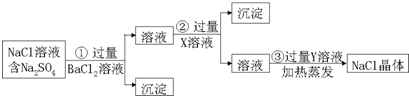
分析 根据除去NaCl固体中混有的少量Na2SO4,加入过量氯化钡,反应生成硫酸钡沉淀;然后加入过量碳酸钠溶液,目的是除去剩余氯化钡而生成碳酸钡沉淀,再加入盐酸可以出去多余的碳酸根离子,盐酸具有挥发性,根据过滤和溶液中获得溶质的方法是蒸发结晶知识进行回答.
解答 解:除去NaCl固体中混有的少量Na2SO4,加入过量氯化钡,反应生成硫酸钡沉淀;然后加入过量碳酸钠溶液,目的是除去剩余氯化钡而生成碳酸钡沉淀,再加入盐酸可以出去多余的碳酸根离子,可以蒸发除去.
(1)加入的X是Na2CO3,Y是HCl,故答案为:Na2CO3;HCl;
(2)加入过量碳酸钠溶液,目的是除去剩余氯化钡而生成碳酸钡沉淀,即Ba2++CO32-═BaCO3↓,再加入盐酸可以出去多余的碳酸根离子,即CO32-+2H+═H2O+CO2↑,故答案为:Ba2++CO32-═BaCO3↓;CO32-+2H+═H2O+CO2↑;
(3)从溶液中提取NaCl采用的方法是蒸发结晶,故答案为:蒸发结晶;
(4)过滤和蒸发实验操作过程中玻璃棒的作用有搅拌、引流,除了玻璃棒外,还需要用到的玻璃仪器有漏斗、烧杯,整个过程金属仪器除了铁架台外还有坩埚钳,故答案为:搅拌、引流;漏斗、烧杯;坩埚钳.
点评 通过回答本题知道了混合物分离的方法和除去可溶性杂质的方法,不能引入新的杂质,并且注意顺序.


科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,0.5 mol任何气体的体积都必定是11.2 L | |
| B. | 在标准状况下,1 mol任何物质的体积都约是22.4 L | |
| C. | 常温常压下,1 mol任何气体的体积都约是22.4 L | |
| D. | 在标准状况下,0.5 mol CO2所占有的体积约是11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2、Na2CO3、NaOH、盐酸 | B. | NaOH、BaCl2、Na2CO3、盐酸 | ||
| C. | Na2CO3、NaOH、BaCl2、盐酸 | D. | BaCl2、NaOH、Na2CO3、盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个C-H键的长度相等 | B. | 4个C-H键的强度相同 | ||
| C. | 4个C-H键的夹角相同 | D. | 4个C-H连接成正方形 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com