
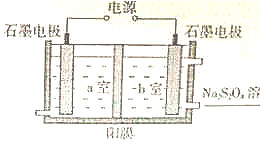
 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )| A. | 光照时,电流由Y流向X | |
| B. | 光照时,Pt电极发生的反应为2Cl-+2e-=Cl2 | |
| C. | 光照时,Cl-向Ag电极移动 | |
| D. | 光照时,电池总反应为:AgCl(s)+Cu+(aq)$\frac{\underline{\;光\;}}{\;}$Ag (s)+Cu2+(aq)+Cl-(aq) |
分析 该装置为原电池,氯原子在银电极上得电子发生还原反应,X为电池的正极,亚铜离子失电子发生氧化反应,Y为电池的正极,放电时,阳离子向正极移动阴离子向负极移动,在得失电子相同条件下,将正负极电极反应式相加得电池反应式,据此分析解答.
解答 解:该装置为原电池,氯原子在银电极上得电子发生还原反应,X为电池的正极,亚铜离子失电子发生氧化反应,Y为电池的正极,
A.放电时,电流从正极沿导线流向负极,即从X流向Y,故A错误;
B.放电时,Pt电极作负极,负极上亚铜离子失电子发生氧化反应,电极反应式为Cu+(aq)-e-=Cu2+(aq),故B错误;
C.光照时,该装置是原电池,银作正极,铂作负极,电解质中氯离子向负极铂移动,故C错误;
D.光照时,正极上氯原子得电子发生还原反应,负极上亚铜离子失电子,所以电池反应式为AgCl(s)+Cu+(aq)$\frac{\underline{\;光\;}}{\;}$Ag (s)+Cu2+(aq)+Cl-(aq),故D正确;
故选D.
点评 本题考查化学电源新型电池,正确判断正负极是解本题关键,难点是电极反应式的书写,要结合电解质特点书写,知道电解质中阴阳离子移动方向,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
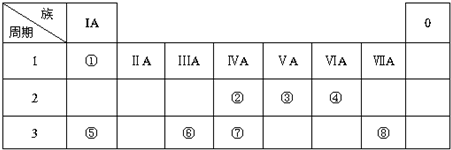
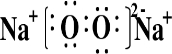 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 操作及现象 | 结论 |
| A | 将0.1 mol•L-1氨水稀释成0.01 mol•L-1,测得 pH由11.1变成 10.6 | 稀释后NH3•H2O的电离程度减小 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于 饱和NaHCO3溶液 | 常温下水解程度: CO32->HCO3- |
| C | 向25 mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 溴乙烷与NaOH乙醇溶液共热产生的气体 通入KMnO4酸性溶液中,溶液褪色 | 产生的气体为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
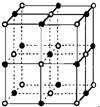 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
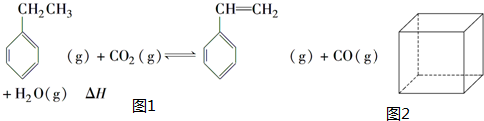
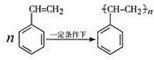 .立方烷(C8H8)的键线式结构如图2所示,它和苯乙烯的关系是同分异构体(填“同位素”、“同素异形体”、“同分异构体”或“同系物”).
.立方烷(C8H8)的键线式结构如图2所示,它和苯乙烯的关系是同分异构体(填“同位素”、“同素异形体”、“同分异构体”或“同系物”).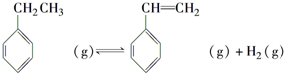 △H1=+117.6kJ•mol-1
△H1=+117.6kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
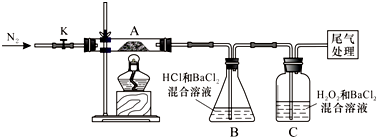
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n | |
| B. | 一种烃在足量的氧气中燃烧并通过碱石灰减少的体积就是生成水蒸气的体积 | |
| C. | 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积改变(温度25℃),若体积减少,则y>4,否则y<4 | |
| D. | 相同质量的烃,完全燃烧,消耗O2越多,烃中含H%越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| -C═C- | ─C≡C─ | ─CH3 | ─CH2CH3或─C2H5 |
| 双键 | 三键 | 甲基 | 乙基 |
| ─OH | -COO-R | ─CHO | ─COOH |
| 羟基 | 醛基 | 酯基 | 羧基 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com