
【题目】Ag2CrO4在水中的沉淀溶解平衡曲线如图所示,t℃时,反应Ag2CrO4(s)+2Cl﹣(aq)=2AgCl(s)+CrO42﹣(aq)的K=2.5×107 , 下列说法正确的是( )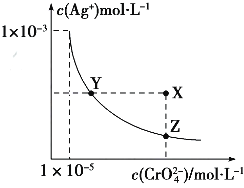
A.t℃时,Ag2CrO4的Ksp为1×10﹣12
B.t℃时,向饱和Ag2CrO4溶液中加入K2CrO4溶液,再次平衡时c2(Ag+)×c(CrO42﹣)>Ksp
C.t℃时,Ksp(AgCl)=1.56×10﹣10
D.t℃时,用0.01molL﹣1 AgNO3溶液滴定20mL 0.01molL﹣1KCl和0.01mol K2CrO4的混合溶液,CrO42﹣先沉淀
【答案】A
【解析】A、依据图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s) ![]() 2Ag+CrO42﹣ ,
2Ag+CrO42﹣ ,
Ksp=c2(Ag+)c(CrO42﹣)=(10﹣3)2×10﹣6=10﹣12 , 所以A正确;
B、溶度积常数只与温度有关,温度不变,溶度积常数不变,所以B错误;
C、Ag2CrO4(s)+2Cl﹣(aq)2AgCl(s)+CrO42﹣(aq)的K=![]()
![]() =2.5×107 , 解Ksp(AgCl)=
=2.5×107 , 解Ksp(AgCl)= ![]() =2×10﹣10 , 所以C错误;
=2×10﹣10 , 所以C错误;
D、依据溶度积常数计算Ksp(CrO42﹣)=c2(Ag+)c(CrO42﹣)=1×10﹣12;Ksp(AgCl)=c(Ag+)×c(Cl﹣)=2×10﹣10 , 以0.01mol/L AgNO3溶液滴定20mL0.01mol/L KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42﹣)=0.01mol/L,得到c(Ag+)= ![]() =1×10﹣5mol/L;0.01mol/L KCl溶液中,c(Cl﹣)=0.01mol/L;依据溶度积计算得到:c(Ag+)=
=1×10﹣5mol/L;0.01mol/L KCl溶液中,c(Cl﹣)=0.01mol/L;依据溶度积计算得到:c(Ag+)= ![]() =2×10﹣8mol/L;所以先析出氯化银沉淀,所以D错误,所以选A.
=2×10﹣8mol/L;所以先析出氯化银沉淀,所以D错误,所以选A.


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 1摩尔是6.02×1023个物质的集体
B. 每摩尔物质含有NA个指定的结构微粒
C. 0.012 kg12C所含的原子数目是6.02×1023个
D. 1 mol MgCl2的质量是95 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过利用如图所示装置(夹持装置略去)实验,探究SO2与Na2O2反应的产物
(1)请分析:
Ⅰ.装置B的作用装置D的作用
Ⅱ.对C中固体产物提出如下假设:假设1:只有Na2SO3 假设2:只有Na2SO4假设3:
若按假设2进行,反应方程式为
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:得出结论:假设2成立
C中的固体配成溶液 ![]() 白色沉淀
白色沉淀 ![]() 沉淀不溶解
沉淀不溶解
该方案是否合理(填“是”或“否”),理由是
(3)若假设2成立,反应前后C管增加6.4g,请计算10g含有杂质的Na2O2固体中,Na2O2的质量分数为(所含的杂质不与SO2发生反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积可变的密闭容器中发生反应:CO(g) + H2O(g) CO 2 (g) + H2O(g)(正反应为放热反应),改变下列条件,不能使ν正 增大的是
A. 升高温度B. 恒容充He
C. 缩小容器体积D. 恒容时充入更多的H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】读下列药品标签,有关分析不正确的是( )
选项 | A | B | C | D |
物品标签 |
|
|
|
|
分析 | 该试剂应装在橡 胶塞的细口瓶中 | 该药品不能与皮肤直接接触 | 受热易分解 | 该药品标签上还标有 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序正确的是
①热稳定性:H2O>HF>H2S ②离子半径:O2->Na+>Mg2+
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
A. ①③ B. ②④ C. ①④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用固体烧碱配制0.4mol/L的NaOH溶液480mL和0.5mol/L的硫酸溶液500mL.请回答:
(1)计算需要NaOH固体质量g.
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒⑥托盘天平 ⑦量筒.配制以上两种溶液必须使用的玻璃仪器(填序号),还缺少的仪器是 .
(3)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL,如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好.
(4)配制过程中,下列操作会引起结果偏高的是(填序号)
①未洗涤烧杯、玻璃棒 ②称量NaOH的时间太长
③定容时俯视刻度 ④容量瓶不干燥,含有少量蒸馏水
⑤NaOH溶液未冷却至室温就转移到容量瓶 ⑥量取浓硫酸时,仰视量筒刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了提纯下列物质(括号内为杂质R所选用的除杂试剂与除杂方法都正确的是
不纯物 | 除杂试剂 | 除杂方法 | |
A. | 乙烷(乙烯) | H2 | Ni/加热 |
B. | 乙醇(水) | CuSO4 | 蒸馏 |
C. | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
D. | 乙酸(水) | Na | 蒸馏 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L的密闭容器中充入7.6mol NO和3.8mol O2 , 发生如下反应:
①2NO(g)+O2(g)2NO2(g)
②2NO2(g)N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )
A.前5min反应的平均速率v(N2O4)=0.36mol(Lmin)﹣1
B.T1℃时反应②的化学平衡常数K=0.6
C.反应①、②均为吸热反应
D.若起始时向该容器中充入3.6mol NO2和2.0mol N2O4 , T1℃达到平衡时,N2O4的转化率为10%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com