
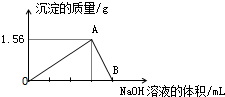
 向40mL某AlCl3溶液中滴加2mol•L-1的NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向40mL某AlCl3溶液中滴加2mol•L-1的NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:分析 (1)开始AlCl3与NaOH反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量;
(2)根据Al3++3OH-=Al(OH)3↓计算消耗NaOH物质的量,再根据V=$\frac{n}{c}$计算消耗NaOH溶液体积;
(3)随后再加NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,沉淀量又逐渐减少,到B点时Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解消失;
(4)根据Al原子守恒n[AlCl3]=n[Al(OH)3]=0.02mol,再根据c=$\frac{n}{V}$计算;
(5)根据反应Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O写出总反应.
解答 解:(1)开始AlCl3与NaOH发生反应Al3++3OH-=Al(OH)3↓生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量,其物质的量为$\frac{1.56g}{78g/mol}$=0.02mol,
故答案为:Al(OH)3;0.02mol;
(2)根据Al3++3OH-=Al(OH)3↓可知,消耗NaOH物质的量=0.02mol×3=0.06mol,消耗NaOH溶液体积为$\frac{0.06mol}{2mol/L}$=0.03L,即为30mL,
故答案为:30mL;
(3)Al(OH)3沉淀达到最大量后,再加NaOH溶液发生反应:Al(OH)3+OH-=AlO2-+2H2O,沉淀量开始逐渐减少,到B点时Al(OH)3与NaOH恰好完全反应生成NaAlO2,沉淀完全溶解消失,B点溶液中溶质有NaCl、NaAlO2,
故答案为:NaCl、NaAlO2;
(4)根据Al原子守恒n[AlCl3]=n[Al(OH)3]=0.02mol,AlCl3溶液的浓度为$\frac{0.02mol}{0.04L}$=0.5mol/L,
故答案为:0.5mol/L;
(5)由反应Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O可知,铝离子与氢氧根离子的总反应为:Al3++4OH-=AlO2-+2H2O,
故答案为:Al3++4OH-=AlO2-+2H2O.
点评 本题考查化学方程式计算、铝元素化合物性质等,侧重考查学生对图象的解读能力、分析问题能力、计算能力,题目难度中等,关键是明确NaOH溶液逐滴加入到AlCl3溶液中的反应原理.


科目:高中化学 来源: 题型:解答题
 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如表:
X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如表:| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 离子半径:Na+>Al3+ | |
| B. | 铝钠合金若投入一定水中可得无色溶液并产生气泡 | |
| C. | 若mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越少 | |
| D. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| B. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴单质 | |
| C. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| D. | 蒸馏操作时,应向蒸馏烧瓶中加入几块沸石,以防止暴沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com