
 ��1�������£�0.5mol�״��������г�ȫȼ������CO2��Һ̬ˮ���ų�����363.3kJ��д ���״�ȼ�յ��Ȼ�ѧ����ʽCH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��l����H=-726.6kJ•mol-1��
��1�������£�0.5mol�״��������г�ȫȼ������CO2��Һ̬ˮ���ų�����363.3kJ��д ���״�ȼ�յ��Ȼ�ѧ����ʽCH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��l����H=-726.6kJ•mol-1������ ��1�������Ȼ�ѧ����ʽ��д��������ע���ʾۼ�״̬�ͷ�Ӧ�ʱ�д���Ȼ�ѧ����ʽ��
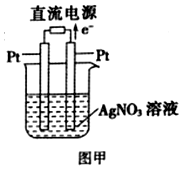
��2�����ж����������ʣ�Ȼ�������������������Һ�м��������γɵĻ����T�ɣ�
��3�����ӴӸ�����������������Һ���������������������������·���������������õ��ӷ�����ԭ��Ӧ�ݴ���д�缫��Ӧ����ʽ��
��4������ȼ�ϵ���У�������Ͷ��ȼ�ϼ��飬����ʧ���ӷ���������Ӧ��������Ͷ�������������õ��ӵĻ�ԭ��Ӧ�������õ��ӷ�����ԭ��Ӧ�ݴ���д�缫��Ӧ����ʽ��
��� �⣺��1��0.5mol�״��������г�ȫȼ������CO2��Һ̬ˮ���ų�����363.3kJ��1mol�״��������г�ȫȼ������CO2��Һ̬ˮ���ų�����726.6kJ����Ӧ���Ȼ�ѧ����ʽΪCH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��l����H=-726.6kJ•mol-1��
�ʴ�Ϊ��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��l����H=-726.6kJ•mol-1��
��2��CuSO4��Һ���ڵ�������Ϊ��SO42-��OH-��OH-���ӵķŵ���������SO42- ���ӵķŵ�����������OH-���ӷŵ�������������Ӧ�ĵ缫����ʽΪ 4OH--4e-=2H2O+O2��
��Һ�д��ڵ���������Cu2+��H+��Cu2+���ӵķŵ���������H+���ӵķŵ�����������Cu2+���ӷŵ�����Cu����Ӧ�ĵ缫����ʽΪ Cu2++2e-=Cu��
�������ͭ�ķ���ʽΪ��2CuSO4+2 H2O$\frac{\underline{\;���\;}}{\;}$2 Cu+O2 ��+2H2SO4��
���Դ���Һ��������������������ͭ���൱������CuO����������Һ�м�������ͭ���ɣ���ѡA���ɵ缫����ʽ4OH--4e-=2H2O+O2֪OH-�������ĵ�����PHֵ��С����������ӷ���ʽΪCu2++2H2O=O2+4H++2Cu��
�ʴ�Ϊ��A�� ��С��Cu2++2H2O=O2+4H++2Cu��
��3�����ӴӸ�����������������Һ���������������������������·���������������Pt�缫�����������������õ��ӷ�����ԭ��Ӧ���ʵ缫��Ӧ����ʽΪAg++e-=Ag��
�ʴ�Ϊ��������Ag++e-=Ag��
��4��������Ͷ��ȼ�ϼ��飬��ͨ������Ϊ������������Ͷ���������õ��ӷ�����ԭ��Ӧ���ʵ缫��Ӧ����ʽ 2H2O+O2+4e-=4OH-��
�ʴ�Ϊ������2H2O+O2+4e-=4OH-��
���� ���⿼�����Ȼ�ѧ����ʽ����д���缫����ʽ����д���Լ����ԭ��������ȷ�ж���Һ�����ӵķŵ�˳�����Ѷ��еȣ�


 С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д� һ������ϵ�д�
һ������ϵ�д� �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д� �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д� ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2N | B�� | Fe | C�� | 2H2O | D�� | 2SO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
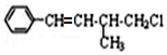 ������������ȷ���ǣ�������
������������ȷ���ǣ�������| A�� | 1mol ���л����ڼ��Ⱥʹ��������£�����ܺ�4 mol H2��Ӧ | |
| B�� | ���л������ʽΪC11H13Cl | |
| C�� | ���л�����ͨ���ӳɡ���ȥ��ˮ��������Ӧ���ɣ� | |
| D�� | ���л�������������Һ���ܲ�����ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
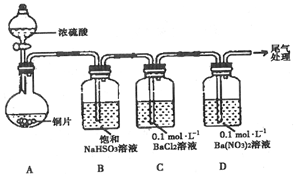
| ��� | ʵ����� | ʵ������ |
| 1 | ȡ0.3g������Na2SO3���壬�����м���10mL��2mol•L-1�����ᣬ�ٵ���4��BaCl2��Һ | ������ɫ���ݣ�����BaCl2��Һ��ʼ������4min����Һ����� |
| 2 | ȡ0.3g������Na2SO3���壬�����м���10mL��2mol•L-1��HNO3���ٵ���4��BaCl2��Һ | ������ɫ���ݣ�����BaCl2��Һ��ʼ������2h����Һ����� |
| 3 | ȡ0.3g������Na2SO3���壬�����м���10mL��ŨHNO3���ٵ���4��BaCl2��Һ | ��������ɫ���壻����BaCl2��Һ����Һ��������������ɫ���� |
| ��� | ʵ����� | ʵ������ |
| 4 | ȡ0.3g����Na2SO3��1.17gNaCl������������м���10mL��2mol•L-1��HNO3���ٵ���4��BaCl2��Һ | ������ɫ���ݣ�����BaCl2��Һ��ʼ������20min����Һ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 28b/a | B�� | 29a/b | C�� | ab/28 | D�� | 28a/b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �ŵ�ʱ����������pH���� | |
| B�� | �ŵ�ʱ�������ĵ缫��ӦʽΪPbO4+4H++2e-�TPb2++2H2O | |
| C�� | ���ʱ��Ǧ�缫���Դ���������� | |
| D�� | ���ʱ������������20.7g Pbʱ��Һ����0.2mol����ͨ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 25�棬Cu��OH��2 ��ˮ�е��ܶȻ������� Cu��NO3��2 ��Һ�еĴ� | |
| B�� | һ���¶��£��� 0.10 mol/L�İ�ˮ��ˮϡ�ͣ���Һ�и�����Ũ�Ⱦ���С | |
| C�� | H3PO2 ����һԪ���ᣬ�� H3PO2 ����� NaOH ��Һ��Ӧ�����ӷ���ʽΪ��H3PO2+3OH?�TPO23-+3H2O | |
| D�� | �����£�NaHS ��Һ�У�c��H+��+c��H2S���Tc��S2-��+c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ۡ���֬����������һ�������¶����Է���ˮ�ⷴӦ | |
| B�� | �屽�����б����ϵ�һ����ԭ�ӱ�-C4H9ԭ����ȡ���γɵ�ͬ���칹�干��12�� | |
| C�� | �����ʵ�������ϩ���Ҵ��������г��ȼ�պ��������ͬ | |
| D�� | �����л�����ϩ����ʹ��������Ȼ�̼��Һ������KMnO4��Һ��ȥ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com