
反应A(g) 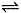 B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题: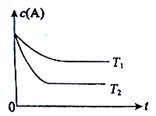
(1)上述反应的温度T1 T2,平衡常数K(T1) K(T2)。(填“大于”、“小于” 或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为 。
②反应的平衡常数K= 。
③反应在0~5min区间的平均反应速率v(A)= 。
(1)小于 小于 (2)①0.085mol ②0.082mol/L ③0.007mol/(L·min)
解析(1)图中显示,T2时达到平衡所用时间少,反应速率大所以温度高;而温度越高c(A)越小,说明升温反应向正反应方向移动,则正反应为吸热反应,升温K将增大。
(2)根据反应: A(g) 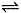 B(g) +C(g)
B(g) +C(g)
反应前:(mol/L) 0.050 0 0
转化量:(mol/L) 0.035 0.035 0.035
平衡时:(mol/L) 0.015 0.035 0.035
则①平衡时体系总的物质的量为(0.015+0.035+0.035)mol/L×1L=0.085mol。
②反应的平衡常数K=c(B)c(C)/c(A)=(0.035 mol/L)2/0.015 mol/L =0.082mol/L。
反应在0~5min区间的平均反应速率v(A)= (0.035 mol/L)/5min=0.007mol/(L·min)。
【考点定位】本题考查化学反应速率和化学平衡。


科目:高中化学 来源: 题型:
(10分)回答下列问题:
(1)反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
或“无法确定”)。
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)= CO (g)+ H2O (g) △H1= +34.0 kJ/mol
甲酸(g)= CO2 (g)+ H2(g) △H2= —7.0kJ/mol
则甲酸的分子式为 ,在该条件下,气态CO2和气态H2反应生成气态CO和气态H2O的热化学方程式为 。
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:
I若试管内液面上升,则正极反应: 。
II若试管内液面下降,则发生 腐蚀。
III若溶液甲为水,溶液乙为海水,则铁钉在 (填“甲”或“乙”)溶液中腐蚀的速度快。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省龙岩一中高二第二学段(模块)考试化学试卷 题型:填空题
(10分)回答下列问题:
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
或“无法确定”)。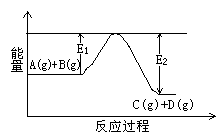
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=" CO" (g)+ H2O (g) △H1=" +34.0" kJ/mol
甲酸(g)= CO2 (g)+ H2(g) △H2=" —7.0" kJ/mol
则甲酸的分子式为 ,在该条件下,气态CO2和气态H2反应生成气态CO和气态H2O的热化学方程式为 。
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:
I若试管内液面上升,则正极反应: 。
II若试管内液面下降,则发生 腐蚀。
III若溶液甲为水,溶液乙为海水,则铁钉在 (填“甲”或“乙”)溶液中腐蚀的速度快。
查看答案和解析>>
科目:高中化学 来源:2013届福建省高二第二学段(模块)考试化学试卷 题型:填空题
(10分)回答下列问题:
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H
0(填“>”、“<”、
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H
0(填“>”、“<”、
或“无法确定”)。

(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)= CO (g)+ H2O (g) △H1= +34.0 kJ/mol
甲酸(g)= CO2 (g)+ H2(g) △H2= —7.0 kJ/mol
则甲酸的分子式为 ,在该条件下,气态CO2和气态H2 反应生成气态CO和气态H2O的热化学方程式为 。
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:

I若试管内液面上升,则正极反应: 。
II若试管内液面下降,则发生 腐蚀。
III若溶液甲为水,溶液乙为海水,则铁钉在 (填“甲”或“乙”)溶液中腐蚀的速度快。
查看答案和解析>>
科目:高中化学 来源:2013届江西省南北校区高二9月份联考化学试卷 题型:填空题
(原创题)(8分)反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

(1)该反应是__________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率________
(填“增大”“减小”“不变”)。
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化
是:E1_______,E2_______(填“增大”“减小”“不变”)。
(4)已知下列热化学方程式:
①H2(g) +1/2O2 (g) =H2O(l);ΔH=-285 kJ·mol-1
②H2(g) +1/2O2 (g) =H2O(g);ΔH=-241.8 kJ·mol-1
③C(s) +1/2O2 (g) =CO(g);ΔH=-110.5 kJ·mol-1
④ C(s) +O2 (g) =CO2(g);ΔH=-393.5 kJ·mol-1
回答下列问题:
① 燃烧1gH2生成液态水,放出的热量为 。
②写出CO燃烧热的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:0103 期中题 题型:填空题
 C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com