
 .
. $→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O.
$→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O. 、
、 、
、 .
. 分析 该酸中C、H、O的质量比为24:3:40,原子个数比为:$\frac{24}{12}$:$\frac{3}{1}$:$\frac{40}{16}$=4:6:5,其最简式为C4H6O5,该酸蒸气的密度是同温同压下氢气密度的67倍,相对分子质量为:67×2=134,由于最简式C4H6O5的式量为:12×4+6+16×5=134,则该酸分子式为:C4H6O5;0.lmol该酸与足量NaHCO3反应放出4.48L CO2,二氧化碳的物质的量为:$\frac{44.8L}{22.4L/mol}$=0.2mol,说明该酸分子中含有两个羧基;0.1mol该酸与足量金属Na反应放出3.36LH2,氢气的物质的量为:$\frac{33.6L}{22.4L/mol}$=0.15mol,说明该酸中含有2个羧基外,还应该含有1个羟基,又由于其分子中不含支链,则该酸的结构简式为: ,据此进行解答.
,据此进行解答.
解答 解:该酸中C、H、O的质量比为24:3:40,原子个数比为:$\frac{24}{12}$:$\frac{3}{1}$:$\frac{40}{16}$=4:6:5,其最简式为C4H6O5,该酸蒸气的密度是同温同压下氢气密度的67倍,相对分子质量为:67×2=134,由于最简式C4H6O5的式量为:12×4+6+16×5=134,则该酸分子式为:C4H6O5;0.lmol该酸与足量NaHCO3反应放出4.48L CO2,二氧化碳的物质的量为:$\frac{44.8L}{22.4L/mol}$=0.2mol,说明该酸分子中含有两个羧基;0.1mol该酸与足量金属Na反应放出3.36LH2,氢气的物质的量为:$\frac{33.6L}{22.4L/mol}$=0.15mol,说明该酸中含有2个羧基外,还应该含有1个羟基,又由于其分子中不含支链,则该酸的结构简式为: ,
,
(1)由以上分析可知酸的分子式为C4H6O5,结构简式为,故答案为:C4H6O5; ;
;
(2) 分子中含有羧基和羟基,在一定条件下分子内脱水生成不饱和脂肪酸:HOOCCH=CHCOOH,该反应化学方程式为:
分子中含有羧基和羟基,在一定条件下分子内脱水生成不饱和脂肪酸:HOOCCH=CHCOOH,该反应化学方程式为: $→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O,
$→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O,
故答案为: $→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O;
$→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O;
(3) 分子中含有两个羧基、1个羟基,在一定条件下每两个分子发生分子间脱水生成环酯,生成产物的结构简式有:
分子中含有两个羧基、1个羟基,在一定条件下每两个分子发生分子间脱水生成环酯,生成产物的结构简式有: 、
、 、
、 ,
,
故答案为: 、
、 、
、 .
.
点评 本题考查有机推断,题目难度中等,注意熟练掌握常见有机物结构与性质,根据题中信息确定该酸的分子式、结构简式为解答关键,试题侧重考查学生达到分析、理解能力及灵活应用基础知识的能力;(3)为难点,注意正确书写两分子该酸生成环酯的结构简式.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2S+SO2═3S+2H2O | B. | Fe+Cu2+═Fe2++Cu | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
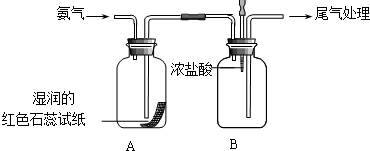 某小组同学利用如图所示装置探究氨气的性质.
某小组同学利用如图所示装置探究氨气的性质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2中的硫元素全部被氧化 | |
| B. | 5molFeS2发生反应,有10mol电子转移 | |
| C. | 产物中SO42-有一部分是氧化产物 | |
| D. | FeS2只用作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业电解饱和食盐水模拟装置的结构如图所示:
工业电解饱和食盐水模拟装置的结构如图所示: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol NH4CuSO3完全反应转移0.5mol电子 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 刺激性气味的气体是氨气 | |
| D. | 反应中硫酸作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 实验次数] | 起始温度t1/°C] | 终止温度t2/°C] | 温度差平均值(t2-t1)/°C] | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com