
下列实验可实现鉴别目的的是
A.用KOH溶液鉴别SO3(g)和SO2
B.用湿润碘化钾淀粉试纸鉴别Br2(g)和NO2
C.用CO2鉴别NaAlO2溶液和CH3COONa溶液
D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液
C
【解析】
试题分析:进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。A、二氧化硫和三氧化硫均是酸性氧化物,都能与氢氧化钾溶液反应,不能鉴别,应该用品红溶液鉴别,A不正确;B、单质溴与NO2气体均具有氧化性,都能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,不能鉴别,应该用硝酸银溶液鉴别,B不正确;C、偏铝酸的酸性弱于碳酸,根据较强酸制备较弱酸可知,CO2通入到偏铝酸钠溶液中生成氢氧化铝白色沉淀;醋酸的酸性强于碳酸,因此CO2通入到醋酸钠溶液中不反应,可以鉴别,C正确;D、氯化钡与硝酸银溶液反应生成氯化银白色沉淀,与硫酸钾溶液反应生成硫酸钡白色沉淀,不能鉴别,应该用硝酸钡溶液鉴别,D不正确,答案选C。
考点:考查物质的鉴别


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源:2013-2014北京市第二学期期中测试高二化学试卷(解析版) 题型:选择题
只用一种试剂鉴别正己烷、1-己烯、乙醇、苯酚水溶液4种无色液体,应选用
A.酸性KMnO4溶液 B.饱和溴水 C.NaOH溶液 D.AgNO3溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市第二学期期中测试高二化学试卷(解析版) 题型:选择题
能够快速、微量、精确的测定相对分子质量的物理方法是
A.质谱 B.红外光谱 C.现代元素分析法 D.核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(重庆卷解析版) 题型:选择题
在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
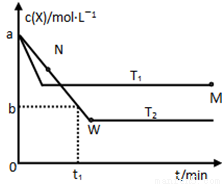
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,υ(Y)= mol/(L·min)
mol/(L·min)
C.M点的正反应速率υ正大于N点的逆反应速率υ逆
D.M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(福建卷解析版) 题型:填空题
(15分)铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
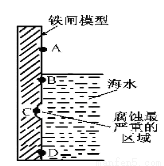
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
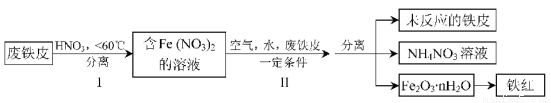
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(福建卷解析版) 题型:选择题
下列关于乙醇的说法不正确的是
A.可用纤维素的水解产物制取 B.可由乙烯通过加成反应制取
C.与乙醛互为同分异构体 D.通过取代反应可制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(海南卷解析版) 题型:选择题
下列除杂操作可行的是
A.通过浓硫酸除去HCl中的H2O B.通过灼热的CuO除去H2中的CO
C.通过灼热的镁粉除去N2中的O2 D.通过水除去CO中的CO2
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标Ⅱ卷解析版) 题型:实验题
(15分)某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1 mol·L—1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
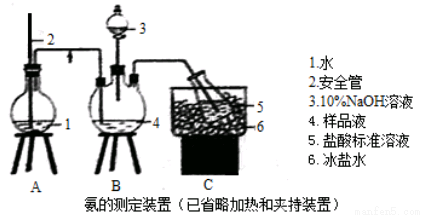
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10—5 mol·L—1,c(CrO42—)为 mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴.氨.氯的物质的量之比为1:6:3,钴的化合价为 ,制备X的化学方程式为 ;X的制备过程中温度不能过高的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com